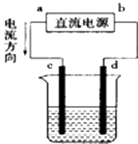
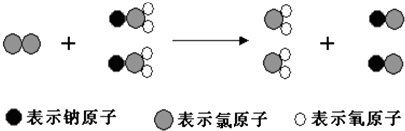
题目内容
【题目】将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气体(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)写出有关反应的方程式,是离子反应的写离子方程式:;;;
(2)2.24L气体的成分为:;
(3)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:第一种情况:n(Na2O2)=mol和n(NaHCO3)=mol;
第二种情况:n(Na2O2)=mol和n(NaHCO3)=mol.
【答案】
(1)2Na2O2+4H+=4Na++O2↑+2H2O;H++HCO3﹣=H2O+CO2↑;2Na2O2+2CO2=2Na2CO3+O2
(2)O2和CO2
(3)0.16;0.02;0.02;0.09
【解析】解:(1)发生反应:2Na2O2+4HCl=4NaCl+2H2O+O2 ↑、②NaHCO3+HCl=NaCl+H2O+CO2↑,生成气体为O2与CO2 , 将生成的干燥气体全部通入另一份Na2O2的NaHCO3的混合粉末,发生反应:2Na2O2+2CO2=2Na2CO3+O2 , 有关离子方程式为:2Na2O2+4H+=4Na++O2↑+2H2O、H++HCO ![]() =H2O+CO2↑;,所以答案是:2Na2O2+4H+=4Na++O2↑+2H2O;H++HCO
=H2O+CO2↑;,所以答案是:2Na2O2+4H+=4Na++O2↑+2H2O;H++HCO ![]() =H2O+CO2↑; 2Na2O2+2CO2=2Na2CO3+O2;(2)由(1)分析可知,2.24L混合气体的成分为:O2和CO2 , 所以答案是:O2和CO2;(3)生成的O2和CO2的物质的量为
=H2O+CO2↑; 2Na2O2+2CO2=2Na2CO3+O2;(2)由(1)分析可知,2.24L混合气体的成分为:O2和CO2 , 所以答案是:O2和CO2;(3)生成的O2和CO2的物质的量为 ![]() =0.1mol,2.016LO2的物质的量为:
=0.1mol,2.016LO2的物质的量为: ![]() =0.09mol,则: 2Na2O2+2CO2=2Na2CO3+O2 气体物质的量减小△n 2 2 1
=0.09mol,则: 2Na2O2+2CO2=2Na2CO3+O2 气体物质的量减小△n 2 2 1
n m 0.1mol﹣0.09mol=0.01mol
则n=m=0.02mol,
①若CO2完全反应,则第一份生成CO2的为0.02mol,O2为:0.1mol﹣0.02mol=0.08mol,则:
2Na2O2+4HCl=4NaCl+2H2O+O2↑
0.16mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2↑
0.02mol 0.02mol,
所以答案是:0.16;0.02;
②若CO2未完全反应,则Na2O2应是0.02 mol,
2Na2O2+4HCl=4NaCl+2H2O+O2↑
0.02mol 0.01mol
则第一份生成O2的为0.01mol,所以CO2为0.1mol﹣0.01mol=0.09mol,
NaHCO3+HCl=NaCl+H2O+CO2↑
0.09mol 0.09mol
所以答案是:0.02;0.09.

【题目】有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+、Na+ 、Cu2+、 Al3+ |
阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、D的化学式:B , D .
(2)C可用作净水剂,用离子方程式表示其净水原理 .
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1molL﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
(4)在mmL b molL﹣1 C溶液中,加入等体积a molL﹣1 的E溶液.当a≤3b时,生成沉淀的物质的量是 mol;当3b<a<4b件时,生成沉淀的物质的量是 mol.
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 .