��Ŀ����
����Ŀ������ƽ�����װ�л�ԭ���£�N2H4 �� ������������ǿ�������������⣨H2O2���������ǻ��ʱ��������������������ˮ���������ų������ȣ�
��1��д����������ĵ���ʽ���µĽṹʽ��
��2����֪0.4molҺ̬�º�����Һ̬�������ⷴӦ�����ɵ�����ˮ����ʱ�ų�256.6KJ��������д����Ӧ���Ȼ�ѧ����ʽ��
��3������ƽ����е���������������NO2���森��֪�����·�Ӧ����N2��g��+2O2��g���T2NO2��g����H1=+67.7KJ/mol
��N2H4��l��+O2��g���TN2��g��+2H2O��g����H2=��534KJ/mol
д������NO2��Ӧ���Ȼ�ѧ����ʽ��
��4��������ӦӦ���ڻ���ƽ��������ͷų����������Ϳ��ٲ������������⣬����һ����ͻ�����ŵ��� ��
���𰸡�
��1��![]() ��
��
��2��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g����H=��641.5kJ/mol
��3��2N2H4��l��+2NO2��g��=3N2��g��+4H2O��g����H=��1135.7KJ/mol
��4������N2��H2O���Ի�������Ⱦ
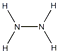
���������⣺��1�������������ʽH2O2 �� ÿ����ԭ���γ��������ۼ������ӵĵ���ʽΪ�� ![]() ���·���ʽΪNH2��NH2 �� ÿ����ԭ���γ�������ѧ�����ṹʽΪ��
���·���ʽΪNH2��NH2 �� ÿ����ԭ���γ�������ѧ�����ṹʽΪ��  �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��  ����2��0.4molҺ̬���������������ⷴӦ�����ɵ�����ˮ�������ų�256.65kJ��������32g��ȼ�շ���641.625kJ����ȼ�յ��Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=��641.625kJ/mol�����Դ��ǣ�N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=��641.625kJ/mol����3����֪��N2��g��+2O2��g���T2NO2��g������H=+67.7KJ/mol����N2H4��g��+O2��g���TN2��g��+2H2O��g������H=��534KJ/mol�����ݸ�˹���ɢڡ�2���ٵõ�����NO2��ȫ��Ӧ���Ȼ�ѧ����ʽ��2N2H4��g��+2NO2��g��=3N2��g��+4H2O��g������H=��1135.7KJ/mol�����Դ��ǣ�2N2H4��g��+2NO2��g��=3N2��g��+4H2O��g����H=��1135.7KJ/mol����4����ȼ�����ɵ�����ˮ�����ͷŴ����ȺͿ��ٲ������������⣬���ɵ���������Ⱦ�����Դ��ǣ�����N2��H2O���Ի�������Ⱦ��
����2��0.4molҺ̬���������������ⷴӦ�����ɵ�����ˮ�������ų�256.65kJ��������32g��ȼ�շ���641.625kJ����ȼ�յ��Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=��641.625kJ/mol�����Դ��ǣ�N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=��641.625kJ/mol����3����֪��N2��g��+2O2��g���T2NO2��g������H=+67.7KJ/mol����N2H4��g��+O2��g���TN2��g��+2H2O��g������H=��534KJ/mol�����ݸ�˹���ɢڡ�2���ٵõ�����NO2��ȫ��Ӧ���Ȼ�ѧ����ʽ��2N2H4��g��+2NO2��g��=3N2��g��+4H2O��g������H=��1135.7KJ/mol�����Դ��ǣ�2N2H4��g��+2NO2��g��=3N2��g��+4H2O��g����H=��1135.7KJ/mol����4����ȼ�����ɵ�����ˮ�����ͷŴ����ȺͿ��ٲ������������⣬���ɵ���������Ⱦ�����Դ��ǣ�����N2��H2O���Ի�������Ⱦ��

 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�����Ŀ����֤�������д��ڵ�Ԫ�ص�ʵ������У���Ҫ����ѡ�ô�����ǣ� ��
ѡ�� | ���� | ��Ҫ���� |
A | ��ȡ3.0g�ɺ��� | ������ƽ |
B | ���ոɺ�������ȫ��ɻҽ� | ������ |
C | ������к�ĺ�������ˮ�Ļ��Һ | ©�� |
D | �����Ȼ�̼��������ĺ����ҽ�ȡҺ����ȡ�� | ��Һ©�� |
A.AB.BC.CD.D