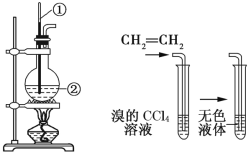
题目内容
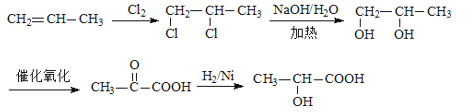
【题目】惕格酸(C5H8O2,分子中有两个甲基)可用于制备香精,由烃A生成惕格酸的反应如下:

(1)写出结构简式。A:_________________C:________________________。
(2)写出反应类型。反应Ⅰ:______________反应、反应Ⅴ:____________反应。
(3)写出反应Ⅱ化学反应方程式:______________________________________。
(4)如何检验 中的溴元素?____________________________。
中的溴元素?____________________________。
(5)写出符合下列条件的惕格酸的同分异构体的结构简式:________________________。条件:与惕格酸含相同官能团,且也有两个甲基。
(6)近年来,乳酸![]() 成为人们的研究热点之一。试写出以丙烯(CH2=CH—CH3)为原料,合成乳酸的路线流程图(无机试剂任选)。___________(合成路线常用的表示方式为:甲
成为人们的研究热点之一。试写出以丙烯(CH2=CH—CH3)为原料,合成乳酸的路线流程图(无机试剂任选)。___________(合成路线常用的表示方式为:甲![]() 乙…
乙…![]() 目标产物)
目标产物)
【答案】![]()
 加成 消去
加成 消去 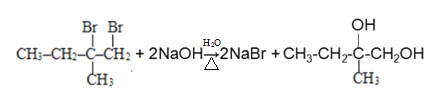 取样向其中加入氢氧化钠溶液,加热,待充分反应后取水溶液,加入足量的稀硝酸使溶液呈酸性,再加入硝酸银溶液,若生成淡黄色沉淀,则说明有机物中含有溴元素
取样向其中加入氢氧化钠溶液,加热,待充分反应后取水溶液,加入足量的稀硝酸使溶液呈酸性,再加入硝酸银溶液,若生成淡黄色沉淀,则说明有机物中含有溴元素 
【解析】
惕各酸的分子式为C5H8O2,不饱和度为2,分子中有两个氧原子和两个甲基,根据反应④的生成物推断,保留了一个羧基,羧基占用了1个不饱和度,另一个不饱和度应该是碳碳双键。又因为分子中有2个甲基,因此推断其分子的结构简式为![]() 。反应I应是烯烃与溴水的加成反应,得到卤代烃;反应II是卤代烃的水解,得到醇;反应III和IV都是氧化,由醇得到酸;反应⑤是醇的消去反应。可推出A为
。反应I应是烯烃与溴水的加成反应,得到卤代烃;反应II是卤代烃的水解,得到醇;反应III和IV都是氧化,由醇得到酸;反应⑤是醇的消去反应。可推出A为![]() ,A与溴水发生加成反应生成
,A与溴水发生加成反应生成 ,B能连续氧化,则
,B能连续氧化,则 在氢氧化钠水溶液、加热条件下发生水解反应生成B,B为
在氢氧化钠水溶液、加热条件下发生水解反应生成B,B为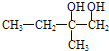 ,C为
,C为 ,C再次被氧化为
,C再次被氧化为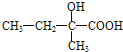 ,
, 在浓硫酸、加热条件下发生消去反应,可得到
在浓硫酸、加热条件下发生消去反应,可得到![]() ,符合题意,据此分析作答。
,符合题意,据此分析作答。
(1)根据上述分析可知,A为![]() ,C为
,C为 ,故答案为:
,故答案为:![]() ;
; ;
;
(2)反应I是![]() 与溴水的加成反应;反应V为
与溴水的加成反应;反应V为 的消去反应,故答案为:加成;消去;
的消去反应,故答案为:加成;消去;
(3)反应Ⅱ是化学反应方程式 在氢氧化钠水溶液、加热条件下发生水解生成
在氢氧化钠水溶液、加热条件下发生水解生成 的过程,其化学方程式为:
的过程,其化学方程式为: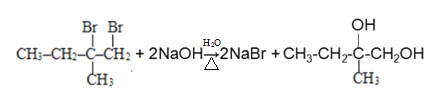
(4)卤代烃在氢氧化钠的水溶液中会发生水解反应,生成的卤族离子可根据与银离子产生沉淀这一现象来间接检测有机物中是否含卤族元素,具体操作为:取样向其中加入氢氧化钠溶液,加热,待充分反应后取水溶液,加入足量的稀硝酸使溶液呈酸性,再加入硝酸银溶液,若生成淡黄色沉淀,则说明有机物中含有溴元素;
(5)惕各酸的分子式为C5H8O2,不饱和度为2,含有1个碳碳双键和1个羧基,则满足上述条件的同分异构体可以为: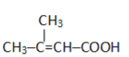 ;
;
(6)根据已知的合成路线,考虑以丙烯(CH2=CH—CH3)为原料合成乳酸,可先将丙烯加成生成卤代烃,得到的卤代烃经过水解反应生成仲醇,该醇再经过催化氧化得到含醛基和羧基的有机物,最后加氢还原得到乳酸的路线,其具体合成步骤如下: 。
。

 名校课堂系列答案
名校课堂系列答案【题目】下表为元素周期表的一部分:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是_______(填元素符号);①的核外电子排布式______;⑤的最外层核外电子的轨道表示式______ ;③和⑥两元素形成化合物的电子式为________。
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是________(填该物质化学式)。
(3)比较④、⑤两种元素的简单离子半径:___>___(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为____________________________。
(4)列举两个事实来证明元素①比元素⑤的非金属性强______;___________。