题目内容
【题目】下表为元素周期表的一部分:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是_______(填元素符号);①的核外电子排布式______;⑤的最外层核外电子的轨道表示式______ ;③和⑥两元素形成化合物的电子式为________。
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是________(填该物质化学式)。
(3)比较④、⑤两种元素的简单离子半径:___>___(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为____________________________。
(4)列举两个事实来证明元素①比元素⑤的非金属性强______;___________。
【答案】Na 1s22s22p4 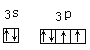
![]() NaOH S2— Al3+ Al(OH)3+3H+= Al3++3H2O 热稳定性H2O比H2S强 H2S水溶液在空气中变浑浊
NaOH S2— Al3+ Al(OH)3+3H+= Al3++3H2O 热稳定性H2O比H2S强 H2S水溶液在空气中变浑浊
【解析】
由周期表的相对位置可知,①为O元素、②为Na元素、③为Mg元素、④为Al元素、⑤为S元素、⑥为Cl元素。
(1)由同周期元素从左到右原子半径依次减小,同主族元素从上到下原子半径依次增大可知,表中左下角Na原子的原子半径最大;O元素的核电荷数为8,最外层电子数为6,则核外电子排布式为1s22s22p4;S元素的价电子排布式为3s23p4,则轨道表示式为 ;镁元素和氯元素形成的化合物为氯化镁,氯化镁为离子化合物,电子式为
;镁元素和氯元素形成的化合物为氯化镁,氯化镁为离子化合物,电子式为![]() ,故答案为:Na;1s22s22p4;
,故答案为:Na;1s22s22p4; ;
;![]() ;
;
(2)金属元素的金属性越强,元素最高价氧化物对应的水化物的碱性越强,同周期元素Na、Mg、Al的金属性依次减弱,则碱性最强的是NaOH,故答案为:NaOH;
(3)同主族元素,从上到下离子半径依次增大,电子层结构相同的离子,核电荷数越大离子半径越小,则离子半径S2—>Al3+;氢氧化铝与硝酸反应生成硝酸铝和水,反应的离子方程式为Al(OH)3+3H+= Al3++3H2O,故答案为:S2—>Al3+;Al(OH)3+3H+= Al3++3H2O;
(4)元素的非金属性越强,对应的氢化物越稳定,O的非金属性大于S,则热稳定性H2O比H2S强;H2S水溶液在空气中变浑浊,是由于发生如下反应:2H2S+O2=2S+2H2O,反应说明O2的氧化性大于S,则O的非金属性强,故答案为:热稳定性H2O比H2S强;H2S水溶液在空气中变浑浊;