题目内容
【题目】白磷与氧气可发生反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为 E(P—P)=a kJ·mol-1、E(P—O)=b kJ·mol-1、E(P=O)=c kJ·mol-1、E(O=O)=d kJ·mol-1。根据图示的分子结 构和有关数据估算该反应的 ΔH 是( )
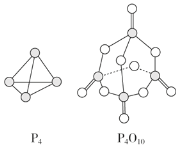
A.(4a+5d-4c-12b) kJ·mol-1B.(4c+12b-4a-5d) kJ·mol-1
C.(4c+12b-6a-5d) kJ·mol-1D.(6a+5d-4c-12b) kJ·mol-1
【答案】D
【解析】
各化学键键能为PPakJmol1、PObkJmol1、P=OckJmol1、O=OdkJmol1,反应热△H=反应物总键能生成物总键能,所以反应P4+5O2=P4O10的反应热△H=6akJmol1+5dkJmol1(4ckJmol1+12bkJmol1)=(6a+5d4c12b)kJmol1。
答案选D。

练习册系列答案
相关题目
【题目】下表为部分一氯代烷的结构简式和沸点数据,下列对表中物质与数据的分析归纳,错误的是( )
物质代号 | 结构简式 | 沸点/℃ |
① |
|
|
② |
| 12.3 |
③ |
| 46.6 |
④ |
| 35.7 |
⑤ |
| 78.44 |
⑥ |
| 68.2 |
⑦ |
| 52 |
A.物质①②③⑤互为同系物
B.一氯代烷同分异构体的沸点随着支链的增多而升高
C.一氯代烷的沸点随着碳原子数的增多而升高
D.物质⑤与⑦互为同分异构体