题目内容
某温度下纯水的 、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
 、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为| A.11:1 | B.9: 2 | C.1:11 | D.2:9 |
D
试题分析:
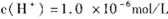 说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,
说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,酸碱混合后,pH=7,则溶液呈碱性,反应剩余 c(OH-)="0.1" mol/L,
则(10-6×x-10-5y)/( x+y) ="0.1" mol/L,
解得x:y=2:9,
故选D。
点评:本题考查酸碱混合的计算,明确混合后pH=10为碱过量是解答本题的关键,并注意pH与浓度的换算来解答,题目难度不大。

练习册系列答案
相关题目

 溶液中,下列等量关系成立的是( )
溶液中,下列等量关系成立的是( )