题目内容
常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是
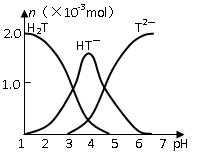

| A.VNaOH=10mL时,溶液中存在C(Na+)=2C(H2T)+2C(H T—)+2C(T 2—) |
| B.VNaOH=20mL时,溶液中存在C(Na+)>C(HT—)>C(H+)>C(H2T)>C(T 2—) |
| C.VNaOH=30mL时,溶液中存在C(Na+)>C(HT—)>C(T 2—)>C(OH—)>C(H+) |
| D.VNaOH=40mL时,溶液中存在C(OH—)=C(HT—)+2C(H2T)+C(H+) |
D
试题分析:当VNaOH=10mL时,溶液中的溶质是NaHT和H2T,所以根据原子守恒可知,选项A不正确,应该是2C(Na+)=C(H2T)+C(H T—)+C(T 2—);当VNaOH=20mL时,溶液中的溶质是NaHT,根据图像可知溶液显酸性,这说明水解程度小于电离程度,所以应该是C(Na+)>C(HT—)>C(H+)>C(T 2—) >C(H2T),B不正确;VNaOH=30mL时,溶液中的溶质是NaHT和Na2T,同样根据图像可知溶液显酸性,所以C(Na+)>C(T 2—) >C(HT—)>C(H+)>C(OH—),C不正确;VNaOH=40mL时,溶液中的溶质是Na2T,则根据质子守恒可知,C(OH—)=C(HT—)+2C(H2T)+C(H+),选项D正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和创新思维能力。该题的关键是利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
 、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为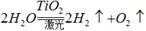 。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是