题目内容
阅读下列实验内容,根据题目要求回答问题:
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)___________________________ 。
②该滴定操作中应选用的指示剂是 ____________ 。
③在G操作中如何确定终点? __________________________ ____ 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______________(填“偏小”、“偏大”或“无影响”)。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是 ___________ 。
(4)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用________________ _的NaOH溶液,原因是__________________________ __________________________ 。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。

(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果保留到小数点后第二位) ___ 。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。 |
| B.用待测定的溶液润洗酸式滴定管。 |
| C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)___________________________ 。
②该滴定操作中应选用的指示剂是 ____________ 。
③在G操作中如何确定终点? __________________________ ____ 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______________(填“偏小”、“偏大”或“无影响”)。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是 ___________ 。
(4)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用________________ _的NaOH溶液,原因是__________________________ __________________________ 。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。

(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果保留到小数点后第二位) ___ 。
(1)①ECDBAGF(2分,其它合理答案也给分)②酚酞 ③溶液由无色变为浅红色(或粉红色)且半分钟内不褪色(2)偏大(3)100mL容量瓶(100未写不给分)
(4)0.1 mol·L-1 溶液浓度越稀,误差就越小
(5)乙(6)偏小(7)4.20mol·L-1(2分,单位不写扣1分)
(4)0.1 mol·L-1 溶液浓度越稀,误差就越小
(5)乙(6)偏小(7)4.20mol·L-1(2分,单位不写扣1分)
试题分析:(1)用标准0.14 mol·L-1NaOH溶液滴定硫酸,首先要检查滴定管是否漏水,再用蒸馏水洗干净滴定管,取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下,然后用待测定的溶液润洗酸式滴定管,再用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂,把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度;另取锥形瓶,再重复操作一次,故①滴定操作的正确顺序为ECDBAGF;②该滴定实验是用标准0.14 mol·L-1NaOH溶液滴定硫酸,所以要用酚酞作为终点的指示剂;③当溶液由无色变为浅红色(或粉红色)且半分钟内不褪色,即可以认为滴定达到终点;(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,说明NaOH溶液的浓度小于0.14mol·L-1,所以会使计算的结果变大;(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是100mL容量瓶;(4)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用0.1 mol·L-1的NaOH溶液,因为溶液浓度越稀,误差就越小;(5)甲为酸式滴定管,乙为碱式滴定管,故用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中;(6)观察碱式滴定管读数时,若滴定前仰视,则读到的数值比实际数值大,滴定后俯视,则读到的数值比实际数值小,所以最后计算时得到的氢氧化钠的体积比实际上的小,故导致测得的稀H2SO4溶液浓度测定值偏小;(7)根据c1v1=c2v2,可以得到0.14×15=2×c2×25,所以c2=0.042mol/L,故待测硫酸(稀释前的硫酸)溶液的物质的量浓度为0.042×100=4.2mol/L。
点评:本题考查酸碱滴定,酸碱滴定是中学的经典实验之一,是高考常考的考点,本题难度不大。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。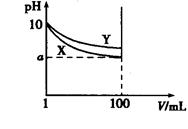
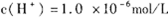 、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为