题目内容
15.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
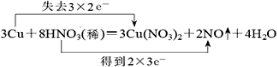 .
.(2)上述反应中氧化剂是HNO3,氧化产物是Cu(NO3)2,HNO3在反应中显示的性质是氧化性和酸性.
(3)上述反应中氧化剂与还原剂的物质的量之比为2:3.
(4)若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是4.48L.
分析 3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O反应中铜元素化合价升高,硝酸中氮元素化合价降低,每消耗3mol铜,失去6mol电子,以此来解答.
解答 解:(1)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素化合价升高,被氧化,为还原剂,N元素化合价降低,被还原,HNO3为氧化剂,Cu(NO3)2是氧化产物,NO是还原产物,反应中硝酸既表现为氧化性又表现酸性,每消耗3mol铜,失去6mol电子,用双线桥标出该反应电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(2)N元素化合价降低,HNO3为氧化剂;Cu元素的化合价升高,Cu被氧化,对应的氧化产物为Cu(NO3)2,硝酸在该反应中体现氧化性和酸性,
故答案为:HNO3;Cu(NO3)2;氧化性和酸性;
(3)由反应可知,3molCu失去电子与2molHNO3得到电子相同,氧化剂与还原剂的物质的量之比为2mol:3mol=2:3,故答案为:2:3;
(4)由反应可知,转移6mol电子生成2molNO,则转移了0.6mol电子,产生的气体在标准状况下的体积是0.2mol×22.4L/mol=4.48L,故答案为:4.48L.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应中元素的化合价变化及氧化还原反应基本概念、转移电子的计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
5.对于密闭容器中进行的反应N2+O2?2NO,下列条件能加快其反应速率的是( )
| A. | 增大体积使压强减小 | B. | 体积不变,充入N2使压强增大 | ||
| C. | 体积不变,充入He使压强增大 | D. | 体积不变,充入气体Ne |
10.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是( )
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 13.8g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 13.8g混合物恰好能与50ml盐酸完全反应 | |
| B. | 根据表中数据不能计算出混合物中NaHCO3的质量分数 | |
| C. | 向50ml盐酸中加入混合物27.6g时,盐酸过量 | |
| D. | 盐酸的物质的量浓度为5.0mol/L |
20.下列变化过程中,只发生物理变化的是( )
| A. | 葡萄酿酒 | B. | 酸雨侵蚀建筑物 | ||
| C. | 空气液化制取氮气 | D. | 钢铁生锈 |
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温下,23g NO2含有NA个氧原子 | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 标准状况下,22.4 L盐酸含有NA个HCl分子 | |
| D. | 常温常压下,22.4L CO2中含有NA个CO2分子 |
4.设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 0.1mol•L-1的NaCl溶液中Cl-的数目为0.1NA | |
| B. | 16g O3中所含的氧原子数为NA | |
| C. | 22.4L H2中含有的氢原子数一定为2NA | |
| D. | 1mol Cl2与过量的金属钠充分反应后,转移的电子数为NA |