题目内容
下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是 (填写编号)。
(2)下列操作合理的是 (填字母)
| A.用25mL碱式滴定管量取20.00mLNaHCO3 |
| B.用托盘天平准确称量10.20克碳酸钠固体 |
| C.用100mL量筒量取3.2mL浓硫酸 |
| D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶 |

(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如上图所示:则所用盐酸溶液的体积为 mL。
(4)图甲表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积为 mL;图乙表示25 mL酸式滴定管中某酸的体积,D与E 之间的刻度差为1 mL,如果刻度D为4,则该酸式滴定管中液体体积的读数为 mL。
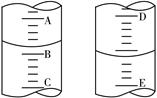
图甲 图乙
(1) ab (2) AD (3) 26.10mL (4)3.2mL 4.60mL
解析试题分析:(1)量筒和容量瓶没有“0”刻度;(2)托盘天平精确度为0.1g,不能精确称量10.20克碳酸钠固体;用100mL的量筒量取3.2mL浓硫酸造成的误差较大,应该用10mL的量筒量取,故B、C错误,A、D操作合理;(3)滴定前液面读数为0.00mL,滴定后液面读数为26.10mL,故所用盐酸的体积为26.10ml;(4)量筒刻度自下而上逐渐增大,若甲图中刻度A为4,则B为3,最小刻度为0.2mL,根据液面高度可判断量筒中液体的体积为3.2mL;滴定管刻度自上而下依次增大,乙图中如果刻度D为4,则E为5,最小刻度为0.1mL,由液面高度可判断滴定管中液体体积的读数为4.60mL(注意精确到0.01mL)。
考点:考查常用定量仪器的使用方法。

下列实验操作或对实验事实的叙述中,正确的是( )
| A.用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质 |
| B.向浓硫酸中缓慢加蒸馏水,以稀释浓硫酸 |
| C.常温下,浓硝酸可贮存于铁制或铝制容器中 |
| D.向溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,说明一定含有SO42— |
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白醋于锥形瓶中,在实验室用浓度为c mol/L的标准NaOH溶液对其进行滴定。
(1)如图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(用实验原始数据列式,不必化简):c= 。
有关钴和铁化合物的性质见下表:
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH) 2 | 5.9×10-15 | 9.4 | CoCl2·6H2O呈红色,常温下稳定。110ºC~120ºC时脱水变成蓝色无水氯化钴 |
| Fe(OH) 2 | 1.6×10-14 | 9.6 | |
| Fe(OH) 3 | 1.0×10-35 | x |
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑工艺流程如下:
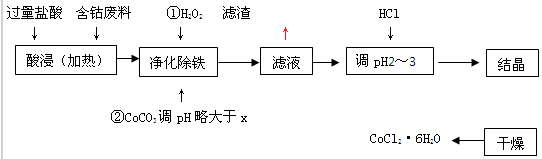
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全。试计算室温下,Fe(OH) 3沉淀完全时,则x= 。
(3)②步中用CoCO3调pH略大于x的原因是 。
(4)滤液中所含溶质有 , 。
(5)为了防止CoCl2·6H2O脱水,“干燥”时宜采用的方法或操作是 , 。
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度
(填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a. 实验1和2探究 ; b. 实验1和3探究反应物浓度对该反应速率的影响; c. 实验1和4探究催化剂对该反应速率的影响。 | |
| 体积 (mL) | 浓度 (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(4)写出表中a 对应的实验目的 ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。

(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,原因可用离子方程式表示为 。
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。 
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有 。
(2)试剂X是
(3)步骤Ⅱ中发生反应的离子方程式是:_______________________________________
(4)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个 ________________________________________。
(5)溶液D中各离子的浓度由大到小的顺序为:__________________________________
(6)工业上由X和F制得CuSO4,还必须使用的最恰当的试剂可以是_____或_________。
| A.浓H2SO4 | B.Fe2O3 | C.HNO3 | D.O2 E.H2O2 |
