题目内容
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白醋于锥形瓶中,在实验室用浓度为c mol/L的标准NaOH溶液对其进行滴定。
(1)如图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,A处的刻度为25,滴定管中液面读数应为 mL。
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(用实验原始数据列式,不必化简):c= 。
(1)25.40 mL (2)A、B (3)C(25.35+25.30)/25.00
解析试题分析:(1)A与C刻度间相差1mL,说明每两个小格之间是0.10mL,A处的刻度为25,A和B之间是四个小格,所以相差0.40mL,则B是25.40mL,故答案为:25.40;(2)A.滴定前滴定管尖嘴有气泡,滴定结束无气泡,导致氢氧化钠体积读数偏大,故A符合;B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,导致氢氧化钠浓度偏小,所以所用氢氧化钠体积偏大,故B符合;C.用氢氧化钠溶液滴定锥形瓶内醋酸的物质的量,锥形瓶不能润洗,操作正确,故C不符合;D.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积,读数刻度在液面上方,导致氢氧化钠体积读数偏小,故D不符合;故答案为:AB;(3)第一次消耗氢氧化钠溶液体积过大,应舍去,利用第二、三次消耗NaOH溶液的平均体积=(25.35+25.30)/2 mL,醋酸和氢氧化钠反应的物质的量相等,故该白醋中醋酸的物质的量浓度=[(25.35+25.30)/2 mL×c mol/L]/V mL=(25.35+25.30)c/2V mol/L,故答案为:(25.35+25.30)c/2V mol/L
考点:配置一定物质的量浓度的溶液

 阅读快车系列答案
阅读快车系列答案下述实验能到达预期目的的是
| | 实验内容 | 实验目的 |
| A | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟, 冷却,再加入银氨溶液,水浴加热 | 检验蔗糖是否已水解 |
| B | 将Cl2通入NaBr溶液中 | 比较Cl2与Br2的氧化性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后,用冰水 混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 往鸡蛋清溶液中加入少量CuSO4溶液 | 研究蛋白质的盐析现象 |
下列做法不正确的是( )
| A.将浓硝酸保存在无色玻璃瓶中 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.加热后的试管不能立即用冷水冲洗,防止骤冷炸裂 |
| D.进行蒸发时蒸发皿放在铁圈上直接加热,并用坩埚钳夹取 |
下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是 (填写编号)。
(2)下列操作合理的是 (填字母)
| A.用25mL碱式滴定管量取20.00mLNaHCO3 |
| B.用托盘天平准确称量10.20克碳酸钠固体 |
| C.用100mL量筒量取3.2mL浓硫酸 |
| D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶 |

(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如上图所示:则所用盐酸溶液的体积为 mL。
(4)图甲表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积为 mL;图乙表示25 mL酸式滴定管中某酸的体积,D与E 之间的刻度差为1 mL,如果刻度D为4,则该酸式滴定管中液体体积的读数为 mL。
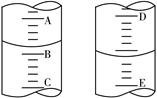
图甲 图乙
碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
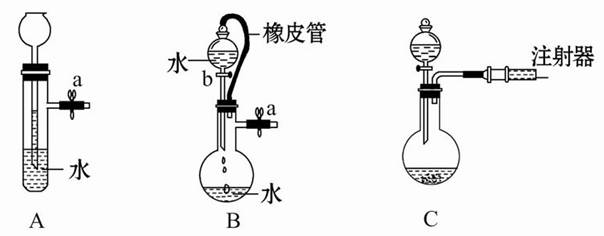
Ⅰ.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:

(1)请选择必要地装置,按气流方向连接顺序为 。
(2)分液漏斗中的液体最适合的是 。
| A.稀盐酸 | B.稀硫酸 | C.浓硝酸 | D.氢氧化钠 |
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(1)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用 (填“酸式”或“碱式”)滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴 指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
达滴定终点时的现象为 ,由此可计算出该样品中的氮的质量分数为 。
(2)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值 (填“偏大”“偏小”或“无影响”)。
Ⅲ.如果测定碳酸氢铵中的含氮量时,使用甲醛法是否合理 (填“是”或“否”),理由是 。
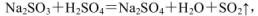 ,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
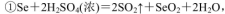
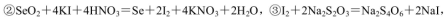 通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol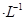 的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。