题目内容
溴是一种重的化工原料,从淡化海水中提取溴的工艺流程如下

(1)操作Ⅱ中,用饱和Na2CO3碱性溶液吸收Br2,过程中有CO2产生,反应的粒子方程式为 ,当0.6molBr2被吸收时,转移电子的数目为 .
(2)步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有 (填序号).
a.烧杯 b.分液漏斗 c.普通漏斗 d.玻璃棒 e.蒸发皿 f.冷凝管
(3)某化学兴趣小组利用高猛酸钾和浓盐酸反应制取氯气,并探究氯水的性质
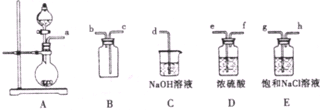
①将A,B,C相连,制得Cl2后加入适量水,即可制得氯水,将所得氯水分为两份,进行甲,乙两个实验,实验操作如下,将现象①填入下表:
②由实验乙不能推出氯气与水反应的产物具有酸性,原因是 ,若要制备纯净干燥的Cl2,按气流方向连接各仪器接口,顺序为a→ → → → → → →d
③实验完毕后,假设装置C中氢氧化钠和Cl2恰好完全反应,其反应方程式为 ,反应后溶液中离子浓度由大到小的顺序为 ,常温下HClO的电离平衡常数为K,则常温下NaClO水解反应的平衡常数为 (用含Ka和Kw的表达式表示)

(1)操作Ⅱ中,用饱和Na2CO3碱性溶液吸收Br2,过程中有CO2产生,反应的粒子方程式为
(2)步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有
a.烧杯 b.分液漏斗 c.普通漏斗 d.玻璃棒 e.蒸发皿 f.冷凝管
(3)某化学兴趣小组利用高猛酸钾和浓盐酸反应制取氯气,并探究氯水的性质

①将A,B,C相连,制得Cl2后加入适量水,即可制得氯水,将所得氯水分为两份,进行甲,乙两个实验,实验操作如下,将现象①填入下表:
| 实验序号 | 实验操作 | 现象 |
| 甲 | 将氯水滴入品红溶液 | ① |
| 乙 | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
③实验完毕后,假设装置C中氢氧化钠和Cl2恰好完全反应,其反应方程式为
考点:海水资源及其综合利用,氯、溴、碘的性质实验
专题:实验题
分析:(1)由图可知,操作Ⅱ中,用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时有CO2放出;根据方程式确定转移的电子数;
(2)萃取、分液必须用到的仪器是分液漏斗,烧杯,蒸馏中用到蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等;
(3)①氯气和水反应生成HClO和盐酸,HClO具有漂白性,盐酸具有酸性;
②新制取的氯气中含HCl气体,也能与碳酸钠溶液反应;若要制备纯净干燥的Cl2,必须除去氯化氢和水,先通过饱和氯化钠溶液除去氯化氢,再通过浓硫酸除去水,最后通过长进短出收集气体;
③氯气和氢氧化钠反应产生氯化钠、次氯酸钠和水;根据恰好完全反应时氯化钠和次氯酸的物质的量相等,但次氯酸钠水解来分析;根据平衡常数概念可知,常温下HClO的电离平衡常数为K电离平衡常数Ka=
,
借助于水的离子积常数Kw=C(H+)?C(OH-),求出常温下NaClO水解反应的平衡常数K=
;
(2)萃取、分液必须用到的仪器是分液漏斗,烧杯,蒸馏中用到蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等;
(3)①氯气和水反应生成HClO和盐酸,HClO具有漂白性,盐酸具有酸性;
②新制取的氯气中含HCl气体,也能与碳酸钠溶液反应;若要制备纯净干燥的Cl2,必须除去氯化氢和水,先通过饱和氯化钠溶液除去氯化氢,再通过浓硫酸除去水,最后通过长进短出收集气体;
③氯气和氢氧化钠反应产生氯化钠、次氯酸钠和水;根据恰好完全反应时氯化钠和次氯酸的物质的量相等,但次氯酸钠水解来分析;根据平衡常数概念可知,常温下HClO的电离平衡常数为K电离平衡常数Ka=
| c(H+)?c(ClO-) |
| c(HClO) |
借助于水的离子积常数Kw=C(H+)?C(OH-),求出常温下NaClO水解反应的平衡常数K=
| C(OH-)?C(HClO) |
| C(ClO-) |
解答:
解:(1)由图可知,操作Ⅱ中,用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时有CO2放出,离子方程式为:3Br2+CO32-+4OH-═5Br-+BrO3-+CO2+2H2O;由离子方程式可知3个Br2转移5个电子,当0.6molBr2被吸收时,转移电子为1mol,即数目为6.02×1023个,
故答案为:3Br2+CO32-+4OH-═5Br-+BrO3-+CO2+2H2O;6.02×1023;
(2)萃取、分液必须用到的仪器是分液漏斗,烧杯,蒸馏中用到蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等,所以步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有普通漏斗、玻璃棒、蒸发皿;
故选:cde.
则确定转移的电子数;3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑;
(3)①氯气和水反应生成HClO具有漂白性,将氯水滴入品红溶液,溶液褪色;
故答案为:溶液褪色;
②新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡;若要制备纯净干燥的Cl2,必须除去氯化氢和水,先通过饱和氯化钠溶液除去氯化氢,再通过浓硫酸除去水,最后通过长进短出收集气体,所以若要制备纯净干燥的Cl2,按气流方向连接各仪器接口,顺序为aghefcb,
故答案为:新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡;ghefcb;
③氯气和氢氧化钠反应产生氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH=NaClO+NaCl+H2O;恰好完全反应时氯化钠和次氯酸的物质的量相等,次氯酸钠水解生成次氯酸和氢氧根离子,溶液呈碱性,离子浓度大小顺序为:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+);
常温下HClO的电离平衡常数为K电离平衡常数Ka=
,水的离子积常数Kw=C(H+)?C(OH-),常温下NaClO水解反应的平衡常数K=
=
;
故答案为:Cl2+2NaOH=NaClO+NaCl+H2O;c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+);
;
故答案为:3Br2+CO32-+4OH-═5Br-+BrO3-+CO2+2H2O;6.02×1023;
(2)萃取、分液必须用到的仪器是分液漏斗,烧杯,蒸馏中用到蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等,所以步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有普通漏斗、玻璃棒、蒸发皿;
故选:cde.
则确定转移的电子数;3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑;
(3)①氯气和水反应生成HClO具有漂白性,将氯水滴入品红溶液,溶液褪色;
故答案为:溶液褪色;
②新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡;若要制备纯净干燥的Cl2,必须除去氯化氢和水,先通过饱和氯化钠溶液除去氯化氢,再通过浓硫酸除去水,最后通过长进短出收集气体,所以若要制备纯净干燥的Cl2,按气流方向连接各仪器接口,顺序为aghefcb,
故答案为:新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡;ghefcb;
③氯气和氢氧化钠反应产生氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH=NaClO+NaCl+H2O;恰好完全反应时氯化钠和次氯酸的物质的量相等,次氯酸钠水解生成次氯酸和氢氧根离子,溶液呈碱性,离子浓度大小顺序为:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+);
常温下HClO的电离平衡常数为K电离平衡常数Ka=
| c(H+)?c(ClO-) |
| c(HClO) |
| C(OH-)?C(HClO) |
| C(ClO-) |
| K W |
| Ka |
故答案为:Cl2+2NaOH=NaClO+NaCl+H2O;c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+);
| K W |
| Ka |
点评:本题考查了方程式的书写、实验仪器的选择、物质的制备原理,涉及知识点较多,题目侧重于反应原理的应用,题目综合性较强,难度中等.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
某溶液由Mg2+、Al3+、Cl-、SO42-四种离子组成,测得其中Al3+的物质量浓度为0.3mol/L,SO42-的物质的量浓度为0.4mol/L,Cl-的物质的量浓度为0.3mol/L,则溶液中Mg2+的物质的量浓度为( )
| A、0.2mol/L |
| B、0.1mol/L |
| C、0.05mol/L |
| D、0.4mol/L |
A、B是短周期ⅤⅡA族的两种元素,A的非金属性比B强.下列关于A、B的说法正确的是( )
| A、A元素的单质可以把B元素的单质从NaB溶液中置换出来 |
| B、NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高 |
| C、HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol HB分子中H-B键断裂时吸收的能量多 |
| D、常温下,NaA、NaB溶液的pH均大于7 |