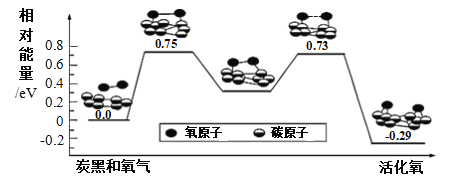
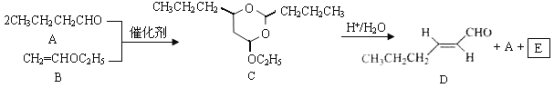
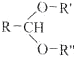
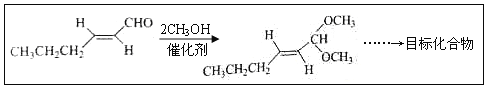
题目内容
【题目】一定条件下,在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() C(g)+nD(g),开始时A为4mol,B为6mol,5min末反应达到化学平衡,此时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol·L-1·min-1。计算:
C(g)+nD(g),开始时A为4mol,B为6mol,5min末反应达到化学平衡,此时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol·L-1·min-1。计算:
(1)平衡时A的物质的量浓度为___。
(2)前5min内用B表示的化学反应速率v(B)为___。
(3)化学方程式中n值为___。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol·L-1·min-1②v(B)=6mol·L-1·min-1③v(C)=0.075mol·L-1·s-1④v(D)=0.1mol·L-1·s-1
其中反应速率最快的是___。
【答案】1.5mol·L-1 0.2mol·L-1·min-1 2 ①
【解析】
利用起始量与某物质的平衡量进行化学方程式中平衡浓度、反应速率及化学计量数的计算时,常将速率转化为变化量,从而建立三段式。比较同一反应在不同条件下反应速率快慢时,应转化为同一物质,然后比较分析。
D表示的化学反应速率v(D)为0.2mol/(L·min),则生成D的物质的量浓度为c(D)= 0.2mol/(L·min)×5min=1mol/L。从而建立以下三段式:
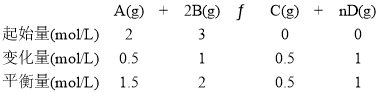
(1)由上面分析可知,5min末A的物质的量浓度为1.5mol·L-1。答案为:1.5mol·L-1;
(2)前5min内用B表示的化学反应速率v(B)=![]() =0.2mol·L-1·min-1。答案为:0.2mol·L-1·min-1;
=0.2mol·L-1·min-1。答案为:0.2mol·L-1·min-1;
(3)由浓度的变化量之比等于化学计量数之比,可得出![]() =
=![]() ,n=2。答案为:2;
,n=2。答案为:2;
(4)为便于比较,将各物质表示的速率都转化为A物质表示的速率,则为:
①v(A)=5mol·L-1·min-1;
②v(B)=6mol·L-1·min-1,v(A)=3mol·L-1·min-1;
③v(C)=0.075mol·L-1·s-1,v(A)=0.075mol·L-1·s-1×60s·min-1=4.5mol·L-1·min-1;
④v(D)=0.1mol·L-1·s-1,v(A)=0.1mol·L-1·s-1×60s·min-1×![]() =3mol·L-1·min-1;
=3mol·L-1·min-1;
以上速率中,5mol·L-1·min-1最大,故反应速率最快的是①。答案为:①。

 字词句段篇系列答案
字词句段篇系列答案