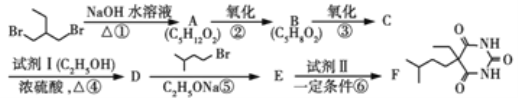
题目内容
【题目】向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并灼烧,得到固体剩余物质的组成可能是( )
A.NaCl、NaBr、Na2SO4B.NaCl、Na2SO4、Br2
C.NaCl、Na2SO4、I2D.NaCl、NaI、Na2SO4
【答案】A
【解析】
通入Cl2后将按顺序发生以下三个反应:①Na2SO3+Cl2+H2O=Na2SO4+2HCl;②2NaI+Cl2=2NaCl+I2;③2NaBr+Cl2=2NaCl+Br2;
A.若剩余固体为NaCl、NaBr、Na2SO4,说明氯气不足,只将SO![]() 和Iˉ氧化,可能将Brˉ氧化,而溴单质易挥发,碘单质易升华,所以剩余固体中没有碘和溴,故A合理;
和Iˉ氧化,可能将Brˉ氧化,而溴单质易挥发,碘单质易升华,所以剩余固体中没有碘和溴,故A合理;
B.溴易挥发,剩余固体中不可能有溴单质,故B不合理;
C.碘单质易升华,剩余固体中不可能有碘单质,故C不合理;
D.若剩余固体中没有NaBr,说明发生了第三个反应,则前两个反应一定完全进行,剩余固体中不可能有NaI,故D不合理;
故答案为A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是____(填元素名称),写出⑧的原子结构示意图______。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是___。
(3)①与⑤形成的化合物中,化学键类型为_____。
(4)⑦与⑨形成的化合物的电子式为___,②与④形成的原子个数比为1:2的化合物的结构式为____。
(5)③、④、⑥的原子半径由大到小的顺序为_____(用元素符号回答)。
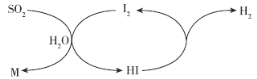
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
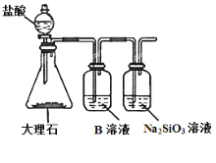
a.溶液B的作用是_______
b.若看到____现象,即可证明酸性_______(用化学式回答),则非金属性_______(用元素符号回答)。
c.上述实验中,能说明②和⑧非金属性强弱的化学方程式是_____________。