题目内容
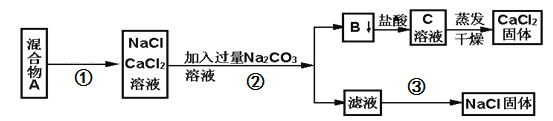
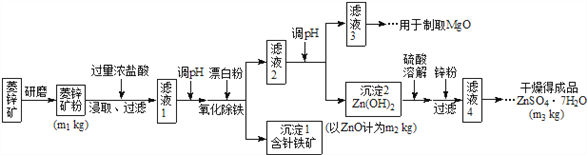
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程示意如下:
请回答下列问题:
(1)将菱锌矿研磨成粉的目的是:______________________________。
(2)漂白粉的有效成分是NaClO,请完成“氧化除铁”步骤中反应的离子方程式:_______________________
□Fe(OH)2+ □ClO- + □_____= □Fe(OH)3 + □ Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是____________(不用考虑化学式中各元素的排列顺序)。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________。
Mg(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 10.4 | 6.4 |
沉淀完全的pH | 12.4 | 8.0 |
开始溶解的pH | — | 10.5 |
(5)假设各步转化均完全,分析图中数据可知:菱锌矿粉中ZnCO3的质量是_____________。
【答案】增大反应物接触面积(或增大反应速率或使反应更充分)2Fe(OH)2 + ClO- + H2O = 2Fe(OH)3 + Cl-FeO(OH)8.0≤pH<10.4125m2/81
【解析】
试题分析:菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,加入过量浓盐酸溶解,过滤除去不溶物,滤液中含有氯化锌、氯化铁、氯化亚铁、氯化镁、氯化钙及未反应的HCl,加入漂白粉将二价铁氧化为三价铁,调节pH得到氢氧化铁沉淀,过滤分离后,再调节滤液pH得到Zn(OH)2沉淀,且不能生成Mg(OH)2。氢氧化锌用硫酸溶解,用Zn粉除去过量的硫酸,将溶液蒸发、结晶、过滤后洗涤并干燥得到晶体,据此分析判断。
解析:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分;
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,反应的离子方程式为2Fe(OH)2 + ClO- + H2O = 2Fe(OH)3 + Cl-;
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH);
(4)调节滤液2的pH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,Mg(OH)2开始沉淀时的pH为10.4、Zn(OH)2开始沉淀时的pH为6.4,Mg(OH)2沉淀完全时的pH为12.4、Zn(OH)2沉淀完全时的pH8.0,所以理论上可选用的最大区间为8.0≤pH<10.4;
(5)设碳酸锌的质量为m,利用关系式法计算:
ZnCO3~~ZnO
125 81
m m2
ZnCO3的质量为125m2/81g。