题目内容
【题目】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
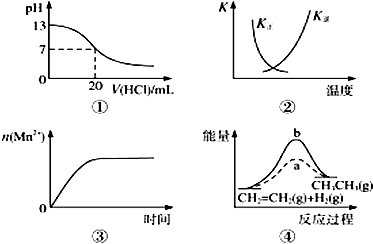
(1)Ⅰ.CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系. 
①该反应的△H0(填“>”、“=”或“<”).
②曲线b表示的物质为 .
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 .
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示. b为电源的极,电解时,生成乙烯的电极反应式是 .
(3)Ⅱ.用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(答一种即可).
(4)Ⅲ.工业上可以用NaOH溶液或氨水吸收过量的SO2 , 分别生成NaHSO3、NH4HSO3 , 其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32﹣)较小的是 , 用文字和化学用语解释原因 .
【答案】
(1)<; H2O;加压(或不断分离出水)
(2)正;2CO2+12e﹣+12H+=C2H4+4H2O
(3)![]() ;通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2
;通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2
(4)NH4HSO3; HSO3﹣?H++SO32﹣,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32﹣)浓度减小
【解析】解:(1)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,
所以答案是:<;
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线,
所以答案是:H2O;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强,
所以答案是:加压(或不断分离出水);(2)电解时,二氧化碳在b极上生成乙烯,得到电子的一极为电源的正极,电极反应式为2CO2+12H++12e﹣=C2H4+4H2O,
所以答案是:正;2CO2+12H++12e﹣=C2H4+4H2O;(3)①T1℃时,由表格数据可知20min达到平衡,平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,则K= ![]() =
= ![]() ,
,
所以答案是: ![]() ;
;
②30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)N2(g)+CO(g),由图表数据分析,平衡状态物质浓度增大,平衡常数K′═ ![]() =
= ![]() ,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;由氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,则改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2,
,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;由氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,则改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2,
所以答案是:通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2.(4)因为HSO3﹣H++SO32﹣,生成亚硫酸根离子,又铵根水解成酸性,抑制亚硫酸氢根的电离,所以NH4HSO3中c(SO32﹣)浓度减小,
所以答案是:NH4HSO3;HSO3﹣H++SO32﹣,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32﹣)浓度减小.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 名校课堂系列答案
名校课堂系列答案【题目】利用化学反应可以为人类提供能源,也可用来解决环境问题。
(1)已知某些化学键的键能数据如下:
化学键 | H-H | O=O | O-H |
键能kJ·mol-1 | 436 | 495 | 463 |
①写出H2与O2反应生成水蒸气的热化学方程式____________;
②利用该反应设计成燃料电池,已知该电池每发1kW·h电能生成360g水蒸气,则该电池的能量转化率为_____%(结果保留三位有效数字)。
(2)三室式电渗析法可以处理含K2SO4的废水,原理如图所示,两极均为惰性电极,ab为阳离子交换膜,cd为阴离子交换膜。
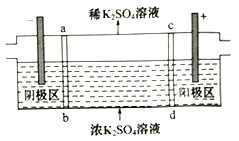
①阴极区的pH______(填“升高”或“降低”);
②阳极发生的电极反应式为__________;
③当电路中通过1mol电子的电量时,阴极上生成气体的体积为_____L(标准状况)。