题目内容
【题目】按照如图所示接通线路,反应一段时间后,根据现象回答下列问题(假设所提供的电能可以保证反应顺利进行). 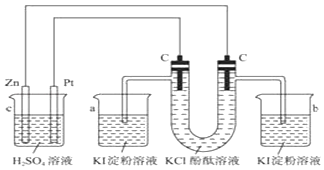
(1)标出电极名称:Zn;C(连Zn) .
(2)U型管中观察到的现象是 , 写出有关的反应方程式: .
(3)如果小烧杯中有0.508g碘析出,则烧杯中负极减轻 .
【答案】
(1)负极;阴极
(2)左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色;2KCl+2H2O ![]() 2KOH+H2↑+Cl2↑
2KOH+H2↑+Cl2↑
(3)0.13g
【解析】解:(1)左装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极,右装置为电解池,C(连Zn)为阴极,所以答案是:负极;阴极;(2)左装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极、Pt作正极,B为电解池,左边C为阳极,阳极上电极反应式为2Cl﹣﹣2e﹣=Cl2↑、阴极反应式为2H2O+2e﹣=H2↑+2OH﹣,阳极上氯离子放电生成黄绿色气体,阴极上生成无色氢气且溶液呈碱性,碱遇酚酞试液变红色,所以U型管中看到的现象是:左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色,
所以答案是:左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色;2KCl+2H2O ![]() 2KOH+H2↑+Cl2↑;(3)如果小烧杯中有0.508g碘析出,析出碘的物质的量=
2KOH+H2↑+Cl2↑;(3)如果小烧杯中有0.508g碘析出,析出碘的物质的量= ![]() =0.002mol,转移电子的物质的量=2×0.002mol=0.004mol,串联电路中转移电子相等,所以消耗Zn的质量=
=0.002mol,转移电子的物质的量=2×0.002mol=0.004mol,串联电路中转移电子相等,所以消耗Zn的质量= ![]() ×65g/molg=0.13g,
×65g/molg=0.13g,
所以答案是:0.13g.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题.
(1)Ⅰ.CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系. 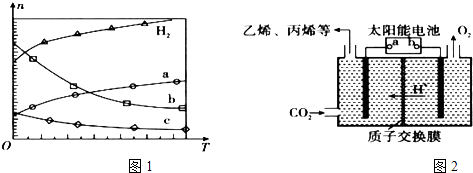
①该反应的△H0(填“>”、“=”或“<”).
②曲线b表示的物质为 .
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 .
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示. b为电源的极,电解时,生成乙烯的电极反应式是 .
(3)Ⅱ.用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(答一种即可).
(4)Ⅲ.工业上可以用NaOH溶液或氨水吸收过量的SO2 , 分别生成NaHSO3、NH4HSO3 , 其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32﹣)较小的是 , 用文字和化学用语解释原因 .
【题目】T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
下列说法正确的是( )
A. 反应在前2 s 的平均速率v(CO)=0.080mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Cl2) =0.11mol·L-1,则反应的ΔH<0
C. T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,达到平衡前v正>v逆
D. T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率为80%