题目内容
【题目】关于下列各图的叙述不正确的是( )
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |

A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
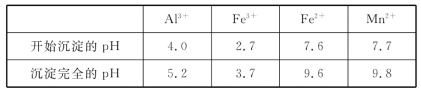
B.某温度下,pH =11的NH3H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05molL-1
C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
【答案】C
【解析】
A. CO的燃烧热283kJ·mol-1,热化学方程式为:CO(g) + ![]() O2(g) = CO2(g) ΔH = -283 kJ·mol-1;O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1;依据盖斯定律第一个方程减去第二个方程的一半得到CO(g) + H2O(g) = CO2(g) + H2(g) ΔH = -41.2 kJ·mol-1,与图象符合,故A正确;
O2(g) = CO2(g) ΔH = -283 kJ·mol-1;O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1;依据盖斯定律第一个方程减去第二个方程的一半得到CO(g) + H2O(g) = CO2(g) + H2(g) ΔH = -41.2 kJ·mol-1,与图象符合,故A正确;
B. 某温度下,pH =11的NH3H2O氢氧根离子浓度为0.001 molL-1,和pH =1的盐酸溶液中氢离子浓度为0.1 molL-1;等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应生成氯化铵浓度为0.05 molL-1;依据物料守恒,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05 molL-1,故B正确;
C. K值越大,说明反应的正向程度越大,即转化率越高;反应的正向程度越小,说明生成物越不稳定,越易分解,反应程度越小,但不能判断与氢气反应的剧烈程度,故C错误;
D. 常温下向弱酸HA的稀溶液中加水稀释过程中,弱酸电离被促进,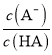 比值增大,符合图象分析,故D正确;
比值增大,符合图象分析,故D正确;
综上所述,答案为C。

 字词句篇与同步作文达标系列答案
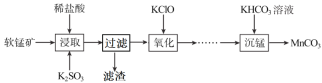
字词句篇与同步作文达标系列答案【题目】无水氯化铝在生产、生活中应用广泛。工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
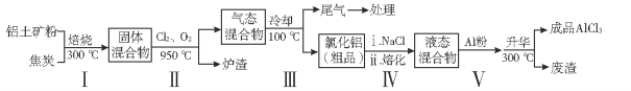
已知:
物质 |
|
|
|
|
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
回答下列问题:
(1)步骤I中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。
(2)请写出步骤I中反应的方程式:________________________、______________________
(3)步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为____________________。
(4)氯化铝粗品中的杂质主要是___________(写化学式)。结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_____________________________。
【题目】下表是25℃时五种物质的溶度积常数,下列有关说法错误的是
化学式 |
|
| CuS |
|
|
溶度积 |
|
|
|
|
|
A.根据表中数据可推知,常温下![]() 在纯水中的溶解度比
在纯水中的溶解度比![]() 的大
的大
B.向![]() 溶液中通入
溶液中通入![]() 可生成CuS沉淀,是因为
可生成CuS沉淀,是因为![]()
C.根据表中数据可推知,向硫酸钡沉淀中加入饱和碳酸钠溶液,不可能有碳酸钡生成
D.常温下,![]() 在
在![]() 溶液中比在
溶液中比在![]() 溶液中的溶解度小
溶液中的溶解度小