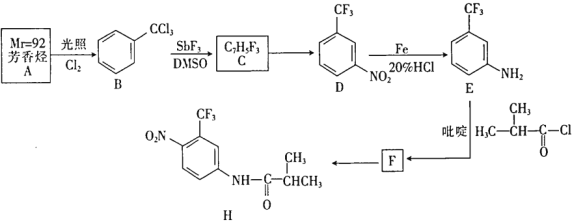
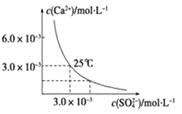
题目内容
【题目】下列关于硫酸的叙述中正确的是( )
A.浓硫酸、稀硫酸都难挥发
B.浓硫酸、稀硫酸都能氧化金属锌,且反应实质相同
C.浓硫酸、稀硫酸在加热时都能与铜反应
D.浓硫酸、稀硫酸在常温下都能用铁制容器贮存
【答案】A
【解析】
A.硫酸是一种高沸点、难挥发性酸,浓硫酸、稀硫酸都难挥发,故A正确;
B.浓硫酸、稀硫酸都能将锌氧化,但浓硫酸、稀硫酸作氧化剂时的反应的实质不同,浓硫酸作氧化剂时还原产物为二氧化硫,而稀硫酸作氧化剂时还原产物为氢气,故B错误;
C.浓硫酸与铜加热时发生反应,而稀硫酸与铜不反应,故C错误;
D.浓硫酸常温下遇铁发生钝化,可以用铁制容器贮存,稀硫酸与铁会发生反应,不能用铁制容器贮存,D错误;
故答案为A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氨的合成对社会发展与进步有巨大贡献。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molN2(g)和3molH2(g) | 2molNH3(g) |
平衡时c(NH3) | c1 | c2 |
平衡时能量变化 | 放出18.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到中平衡状态的是_____(填字母)。
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_____ (填字母)。
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1__c2(填“>”“<”或“=”)。
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是_________。

(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H=_____kJ/mol
2NO(g) △H=_____kJ/mol
②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。
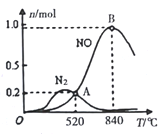
该催化剂在较低温度时主要选择反应___填“反应I”或“反应II”)。当温度高于840℃时,反应I中NO的物质的量减少的原因是________。520℃时,反应I的平衡常数K=____(只列算式不计算)。