题目内容
7.(1)0.1mol某物质的质量是10.6g,则它的摩尔质量是:106g/mol.(2)19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为24.
(3)1.7gNH3所含分子数与2.8g氮气所含分子数相同,与1.4g氮气所含的原子数相同.
(4)一种硫酸溶液的浓度是a mol/L,密度是b g/cm3,则这种溶液的质量分数是:$\frac{98a}{1000b}$.
分析 (1)根据M=$\frac{m}{n}$计算摩尔质量;
(2)计算RCl2的物质的量,再根据M=$\frac{m}{n}$计算RCl2的摩尔质量,进而计算R的相对原子质量;
(3)根据n=$\frac{m}{M}$计算氨气物质的量,分子数目相同,则物质的量相等,再根据m=nM计算氮气质量;
计算氨气含有原子物质的量,根据原子数目相等计算氮气物质的量,再根据m=nM计算氮气质量;
(4)根据c=$\frac{1000ρω}{M}$计算.
解答 解:(1)0.1mol某物质的质量是10.6g,则它的摩尔质量是:$\frac{10.6g}{0.1mol}$=106g/mol,故答案为:106g/mol;
(2)二价金属的氯化物RCl2的物质的量为$\frac{0.4mol}{2}$=0.2mol,其摩尔质量为$\frac{19g}{0.2mol}$=95g/mol,则R的相对原子质量为95-35.5×2=24,故答案为:24;
(3)1.7gNH3的物质的量为$\frac{1.7g}{17g/mol}$=0.1mol,与之含有相同分子数目的氮气为0.1mol,则氮气的质量为0.1mol×28g/mol=2.8g;与含有相同原子数目的氮气为$\frac{0.1mol×4}{2}$=0.2mol,氮气质量为0.2mol×28g/mol=5.6g,故答案为:2.8;5.6;
(4)一种硫酸溶液的浓度是a mol/L,密度是b g/cm3,根据c=$\frac{1000ρω}{M}$可知,溶液质量分数=$\frac{cM}{1000ρ}$=$\frac{98a}{1000b}$,故答案为:$\frac{98a}{1000b}$.
点评 本题考查物质的量有关计算,难度不大,注意理解掌握物质的量浓度与质量分数之间关系.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 气体单质中一定存在σ键,可能存在π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | π键比σ键的电子云重叠程度大 | |
| D. | CH2=CHCl中C-Cl键采用的成键轨道是sp2-s |
| 选项 | 实验目的 | 实验操作 |
| A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
| B | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
| C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
| D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CO2 | B. | NH3 | C. | Cl2 | D. | SO2 |
①氯水 ②浓盐酸 ③硝酸 ④浓硫酸.
| A. | ① | B. | ①②③④ | C. | ①③ | D. | ②③ |
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23-26 |
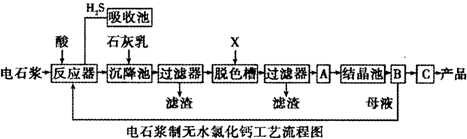
已知氯化钙晶体的化学式是:CaCl2•6H2O;H2S是一种酸性气体,且具有还原性.
(1)反应器中加入的酸应选用盐酸.
(2)脱色槽中应加入的物质X是活性炭;设备A的作用是蒸发浓缩;设备B的名称为过滤器;设备C的作用是脱水干燥.
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是C_.反应的化学方程式为Ca(OH)2+H2S=CaS+2H2O.
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是对母液回收利用,降低废弃物排放量,提高经济效益.
(5)氯碱工业离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
| A. | (CH3)3CCH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CHCH2CH2CH3 |
| A. | v(H2)=0.009mol•(L•s) -1 | B. | v(CO)=0.009mol•(L•min)-1 | ||
| C. | v(C)=0.00015 mol•(L•s) -1 | D. | v(H2O)=0.09mol•(L•min)-1 |