题目内容
15.同温同压下,质量相同的下列气体,体积最大的是( )| A. | CO2 | B. | NH3 | C. | Cl2 | D. | SO2 |
分析 根据n=$\frac{m}{M}$可知,相同质量的气体,其物质的量与摩尔质量成反比,同温同压下,气体体积之比等于其物质的量之比,故相同质量的气体,其体积与摩尔质量成反比,摩尔质量越大,占有的体积越小.
解答 解:CO2的摩尔质量为44g/mol,NH3的摩尔质量为17g/mol,Cl2的摩尔质量为71g/mol,SO2的摩尔质量为64g/mol,根据n=$\frac{m}{M}$可知,相同质量的气体中氨气物质的量最大,同温同压下,气体体积之比等于其物质的量之比,故同温同压下,相同质量的气体,NH3的体积最大,故选B.
点评 本题考查物质的量的有关计算、阿伏伽德罗定律及推论等,比较基础,注意基础知识理解掌握.

练习册系列答案
相关题目
5.某有机物Z具有广泛的抗菌作用,其生成机理可由X与Y相互作用:下列有关叙述中正确的是( )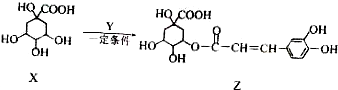

| A. | Z结构中有4个手性碳原子 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1molZ余足量NaOH溶液反应,最多消耗8molNaOH | |
| D. | 1molZ与浓溴水反应最多消耗3molBr2 |
6.下列叙述正确的是( )
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 | |
| C. | 常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-) |
3.某有机物A是农药生产中的一种中间体,其结构简式如下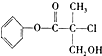 ,下列叙述正确的是( )
,下列叙述正确的是( )
 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 有机物A属于芳香烃 | |
| B. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| C. | 有机物A中含有两种官能团 | |
| D. | l mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
10.下列说法不正确的是( )
| A. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果,其作用是吸收并氧化水果释放出的乙烯 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性都是化学变化 |
20.维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶.它的结构简式为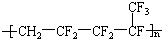 ,则合成它的单体是( )
,则合成它的单体是( )
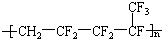 ,则合成它的单体是( )
,则合成它的单体是( )| A. | 氟乙烯和全氟丙烯 | B. | 1,1-二氟乙烯和全氟丙烯 | ||
| C. | 全氟异戊二烯 | D. | 1-三氟甲基-1,3-丁二烯 |
17.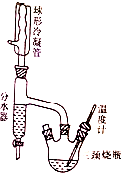 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:
2CH3CH2CH2OH$\stackrel{H_{2}SO_{4},134-135℃}{?}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
温度高于135℃会发生副反应生成丁烯.相关物质的物理性质如下表:
实验步骤如下(装置如图所示):
a.在100mL三颈烧瓶中加入36.5mL正丁醇和约10mL浓硫酸,混合均匀,并加入几粒沸石.
b.在三颈烧瓶的一瓶口装上温度计,另一瓶口装上分水器,分水器上端接回流冷凝管.
c.在分水管中放置2mL水,然后加热到134-135℃,回流,可观察到分水器中水面缓慢上升.
d.实验结束后,冷却反应物,然后将反应后的混合液体倒入35mL水中,充分振摇,静置后分液,分出粗产品.
试回答:
(1)温度高于135℃时所发生反应的化学方程式为CH3CH2CH2CH2OH$→_{高于135℃}^{浓H_{2}SO_{4}}$CH3CH2CH=CH2↑+H2O;
(2)实验中为控制温度在134-135℃,最好选用的加热方式为③;
①水浴 ②砂浴 ③油浴
(3)为提纯粗产品,分别进行了①加入无水氯化钙、②水洗、③碳酸氢钠溶液洗涤,则正确的操作顺序为③②①,其中使用碳酸氢钠溶液洗涤的目的是去除反应的催化剂硫酸,进行水洗时,所用的主要玻璃仪器名称为分液漏斗,该仪器在使用前需要时行的操作是检漏.
(4)在该实验过程中,判断反应基本进行完全的现象是分水器中液面不再上升;
(5)若最终得到13.0g正丁醚,则该实验的产率为50.0%.
 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:2CH3CH2CH2OH$\stackrel{H_{2}SO_{4},134-135℃}{?}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
温度高于135℃会发生副反应生成丁烯.相关物质的物理性质如下表:
| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
a.在100mL三颈烧瓶中加入36.5mL正丁醇和约10mL浓硫酸,混合均匀,并加入几粒沸石.
b.在三颈烧瓶的一瓶口装上温度计,另一瓶口装上分水器,分水器上端接回流冷凝管.
c.在分水管中放置2mL水,然后加热到134-135℃,回流,可观察到分水器中水面缓慢上升.
d.实验结束后,冷却反应物,然后将反应后的混合液体倒入35mL水中,充分振摇,静置后分液,分出粗产品.
试回答:
(1)温度高于135℃时所发生反应的化学方程式为CH3CH2CH2CH2OH$→_{高于135℃}^{浓H_{2}SO_{4}}$CH3CH2CH=CH2↑+H2O;
(2)实验中为控制温度在134-135℃,最好选用的加热方式为③;
①水浴 ②砂浴 ③油浴
(3)为提纯粗产品,分别进行了①加入无水氯化钙、②水洗、③碳酸氢钠溶液洗涤,则正确的操作顺序为③②①,其中使用碳酸氢钠溶液洗涤的目的是去除反应的催化剂硫酸,进行水洗时,所用的主要玻璃仪器名称为分液漏斗,该仪器在使用前需要时行的操作是检漏.
(4)在该实验过程中,判断反应基本进行完全的现象是分水器中液面不再上升;
(5)若最终得到13.0g正丁醚,则该实验的产率为50.0%.