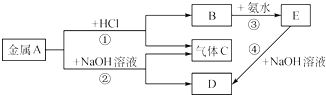
题目内容
5.含铬污水处理是污染治理的重要课题.污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是图1: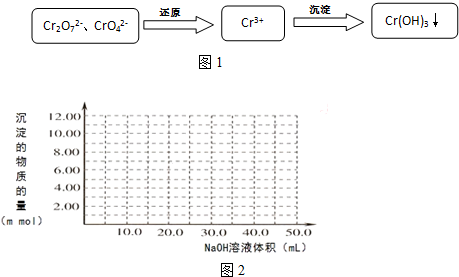
(1)加酸可以使CrO42-转化为Cr2O72-:2CrO42-+2H+?Cr2O72-+H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K=1.0×105.
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O.而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降低到10-5mol•L-1,溶液的pH应升高到5.
(3)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液.Cr(OH)3溶于稀硫酸的化学方程式为2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O. 往100.00mL 0.1000mol•L-1CrCl3溶液滴加1.000mol•L-1NaOH溶液,请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图图2:
分析 (1)根据化学平衡常数K=$\frac{c(Cr{\;}_{2}O{\;}_{7}{\;}^{2-})}{c(CrO{\;}_{4}{\;}^{2-}){\;}^{2}c(H{\;}^{+}){\;}^{2}}$进行计算;
(2)根据二氧化硫具有还原性,在酸性溶液中通SO2将Cr2O72-还原生成硫酸根和三价铬离子;根据Ksp[Cr(OH)3]=10-32计算c(OH-),从而计算PH;
(3)Cr(OH)3溶于稀硫酸生成硫酸铬和水,根据反应的量画出生成沉淀的物质的量与加入NaOH溶液体积的关系图.
解答 解:(1)若常温下pH=1溶液中Cr2O72-浓度为0.1mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍即CrO42-浓度为0.01mol•L-1,化学平衡常数K=$\frac{c(Cr{\;}_{2}O{\;}_{7}{\;}^{2-})}{c(CrO{\;}_{4}{\;}^{2-}){\;}^{2}c(H{\;}^{+}){\;}^{2}}$=$\frac{0.1}{0.01{\;}^{2}×0.1{\;}^{2}}$=1.0×105,故答案为:1.0×105;
(2)因为二氧化硫具有还原性,在酸性溶液中通SO2将Cr2O72-还原生成硫酸根和三价铬离子,所以离子方程式为:3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O;因为Ksp[Cr(OH)3]=10-32,所以c(OH-)=$\root{3}{\frac{10{\;}^{-32}}{10{\;}^{-5}}}$=10-9mol•L-1,则PH=5,故答案为:3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O;5;
(3)Cr(OH)3溶于稀硫酸生成硫酸铬和水,化学方程式为2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O,往100.00mL 0.1000mol•L-1CrCl3溶液滴加1.000mol•L-1NaOH溶液,根据反应Cr3++3OH-=Cr(OH)3,Cr(OH)3+OH-=CrO2-+2H2O,所以应该为三份沉淀,一份溶解,生成沉淀的物质的量与加入NaOH溶液体积的关系图为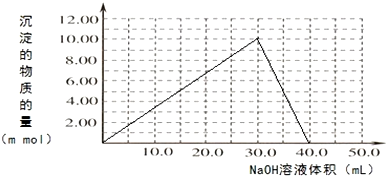 ,故答案为:2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O;
,故答案为:2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O; .
.
点评 本题考查了平衡常数的计算、氧化还原反应等知识点,难度不大,氧化还原反应方程式的书写是高考的热点.

 名校课堂系列答案
名校课堂系列答案甲组:①甘氨酸,②苯酚,③醋酸,④牛油,⑤甲酸甲酯.
乙组:⑥甲醛,⑦溴水,⑧苛性钠溶液,⑨金属钠,⑩氯化铁溶液
甲组有一种物质与乙组中的五种物质均能反应;乙组有一种物质与甲组中的五种物质均能反应,则这两种物质分别是( )
| A. | ①⑦ | B. | ①⑧ | C. | ②⑧ | D. | ⑤⑨ |
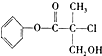 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 有机物A属于芳香烃 | |
| B. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| C. | 有机物A中含有两种官能团 | |
| D. | l mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
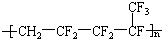 ,则合成它的单体是( )
,则合成它的单体是( )| A. | 氟乙烯和全氟丙烯 | B. | 1,1-二氟乙烯和全氟丙烯 | ||
| C. | 全氟异戊二烯 | D. | 1-三氟甲基-1,3-丁二烯 |
C4H9OH+HB$\stackrel{浓硫酸}{→}$rC4H9Br+H2O
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
请回答下列问题;
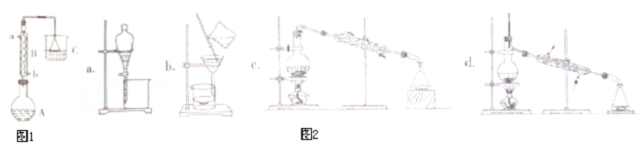
(1)仪器A的名称是圆底烧瓶,仪器B的作用是冷却、回流.操作中加入沸石的作用是防止暴沸.
(2)装置C中盛装的液体是NaOH溶液,其作用是吸收逸出的溴化氢,防止其污染空气.
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由图2操作中的d制备纯净的正溴丁烷.
(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏低(填“高”或“低”),试说出其中一种原因:大火,副反应多或产物逸出较多.
(5)若最终得到13.6g纯净的正溴丁烷,则该实验的产率是49.6%(保留三位有效数字)
 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:2CH3CH2CH2OH$\stackrel{H_{2}SO_{4},134-135℃}{?}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
温度高于135℃会发生副反应生成丁烯.相关物质的物理性质如下表:
| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
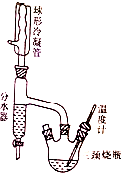
a.在100mL三颈烧瓶中加入36.5mL正丁醇和约10mL浓硫酸,混合均匀,并加入几粒沸石.
b.在三颈烧瓶的一瓶口装上温度计,另一瓶口装上分水器,分水器上端接回流冷凝管.
c.在分水管中放置2mL水,然后加热到134-135℃,回流,可观察到分水器中水面缓慢上升.
d.实验结束后,冷却反应物,然后将反应后的混合液体倒入35mL水中,充分振摇,静置后分液,分出粗产品.
试回答:
(1)温度高于135℃时所发生反应的化学方程式为CH3CH2CH2CH2OH$→_{高于135℃}^{浓H_{2}SO_{4}}$CH3CH2CH=CH2↑+H2O;
(2)实验中为控制温度在134-135℃,最好选用的加热方式为③;
①水浴 ②砂浴 ③油浴
(3)为提纯粗产品,分别进行了①加入无水氯化钙、②水洗、③碳酸氢钠溶液洗涤,则正确的操作顺序为③②①,其中使用碳酸氢钠溶液洗涤的目的是去除反应的催化剂硫酸,进行水洗时,所用的主要玻璃仪器名称为分液漏斗,该仪器在使用前需要时行的操作是检漏.
(4)在该实验过程中,判断反应基本进行完全的现象是分水器中液面不再上升;
(5)若最终得到13.0g正丁醚,则该实验的产率为50.0%.
| A. | M为H2O | |
| B. | 每还原1 mol氧化剂,就有3 mol电子转移 | |
| C. | 还原性:SnCl2>As | |
| D. | 氧化产物和还原产物的物质的量之比为2:3 |