题目内容
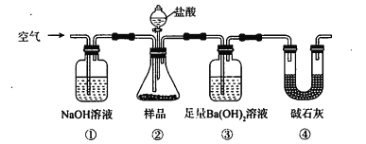
【题目】已知红热的铁能与水蒸气反应生成氢气。现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题。
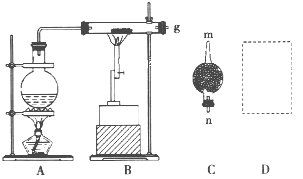
(1)写出铁在高温下与水蒸气反应的化学方程式:____________________________。
(2)干燥管C中盛放的药品是__________,干燥管的_______(填“m”或“n”)端与g导管相连接。
(3)在D处画出用试管收集氢气的装置图(所需其他仪器自行选择)。______________
(4)怎样用简单的方法检验收集到的气体是氢气?简述实验操作步骤和现象:______________。
(5)若收集到标准状况下的![]() 22.4L,则参加反应的铁粉的质量为__________g。
22.4L,则参加反应的铁粉的质量为__________g。
【答案】3Fe+4H2O(g) ![]() Fe3O4+4H2 CaCl2或CaO和NaOH n
Fe3O4+4H2 CaCl2或CaO和NaOH n  试管口向下,用拇指堵住试管口,靠近火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的气体是氢气 42
试管口向下,用拇指堵住试管口,靠近火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的气体是氢气 42
【解析】
(1)在高温条件下水蒸气与铁反应生成Fe3O4和H2;
(2)在高温条件下与铁反应,反应后用干燥管除去多余的水蒸气,所以干燥管C内盛放的药品是固体干燥剂CaCl2和CaO;
(3)由于产生的氢气密度比空气轻,所以收集时要用向下排空气法;
(4)可以用点燃法检验收集到的气体是否是氢气;
(5)根据反应3Fe+4H2O(g) ![]() Fe3O4+4H2计算。
Fe3O4+4H2计算。
(1)根据题目中提供的图可以看出本题实验的原理是前面烧瓶中产生水蒸气,经过横放的硬质玻璃管,在高温条件下与铁反应,反应后用干燥管除去多余的水蒸气,发生的反应为:3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)在高温条件下与铁反应,反应后用干燥管除去多余的水蒸气,所以干燥管C内盛放的药品是固体干燥剂CaCl2或CaO和NaOH,干燥管的n端与g导管相连接;
故答案为:CaCl2或CaO和NaOH;n;
(3)由于产生的氢气密度比空气轻,所以收集时要用向下排空气法,则收集氢气的装置图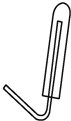 ;
;
(4)可以用点燃法检验收集到的气体是否是氢气.具体做法是试管口向下,用拇指堵住试管口,靠近火焰,松开拇指,能燃烧或发出爆鸣声,说明收集的气体是氢气;
(5)根据反应3Fe+4H2O(g) ![]() Fe3O4+4H2可知,若收集到标准状况下的
Fe3O4+4H2可知,若收集到标准状况下的![]() 22.4L,则参加反应的铁粉的质量为
22.4L,则参加反应的铁粉的质量为![]() ×56g/mol=42g。
×56g/mol=42g。