题目内容
【题目】回答下列问题:
(1)常温下,有pH相同、体积相同的①盐酸和②醋酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,两溶液中的c(H+)变化是醋酸溶液中c(H+)___(填“增大”、“减小”或“不变”),盐酸溶液中c(H+)___(填“增大”、“减小”或“不变”)。
②加水稀释10倍后,醋酸溶液中的c(H+)___盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸___盐酸(填“>”、“=”或“<”)。
④使温度都升高20℃,溶液中c(H+):醋酸___盐酸(填“>”、“=”或“<”)。
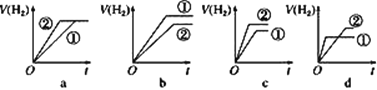
⑤分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是___(填字母)。
(2)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是___(填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
【答案】减小 减小 > > > c ab
【解析】
(1)常温下,有pH相同、体积相同的①盐酸和②醋酸两种溶液,采取以下措施:①CH3COOH![]() CH3COO-+H+,加适量醋酸钠晶体后,c(CH3COO-)增大,平衡左移,c(H+)减小;盐酸溶液中加入醋酸钠晶体后,发生反应:CH3COO-+H+= CH3COOH,c(H+)减小;
CH3COO-+H+,加适量醋酸钠晶体后,c(CH3COO-)增大,平衡左移,c(H+)减小;盐酸溶液中加入醋酸钠晶体后,发生反应:CH3COO-+H+= CH3COOH,c(H+)减小;
故答案是:减小;减小;
②加水稀释10倍后,醋酸的电离平衡向右移动,n(H+)增大;HCl不存在电离平衡,HCl电离出的n(H+)不变;所以加水稀释10倍后,醋酸溶液中的c(H+)大于盐酸溶液中的c(H+);
故答案是:>;
③加等浓度的NaOH溶液,NaOH+CH3COOH=CH3COONa+H2O;HCl+NaOH=NaCl+H2O;由于醋酸部分电离,反应过程中醋酸的电离平衡向电离方向移动,且反应前c(CH3COOH)>c(HCl),故恰好完全中和时,醋酸所需要的氢氧化钠的体积大;
故答案是:>;
④使温度都升高20℃,醋酸的电离平衡向电离方向移动,c(H+)增大,HCl已经完全电离;
故答案是:>;
⑤①盐酸和②醋酸;反应开始两溶液pH相同,即c(H+)相同,所以开始时,与锌反应速率相同,随着反应的进行,醋酸的电离平衡向电离方向移动,故反应速率v(醋酸)> v(盐酸),又因为反应开始时,c(CH3COOH)>c(HCl),所以与足量锌反应,醋酸生成氢气的量多;故选c;
故答案选c。
(2)a.醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,则醋酸的电离程度增大,故a正确;
b.加水稀释醋酸,促进醋酸电离,溶液中离子总数增多,故b正确;
c.加水稀释醋酸,虽然促进醋酸电离,溶液中离子个数增多,但离子浓度降低,所以导电能力减弱,故c错误;
d.加水稀释醋酸,促进醋酸电离,导致醋酸分子数减少,故d错误;
故答案选ab。

 名校课堂系列答案
名校课堂系列答案【题目】Co3O4是制备石墨烯电池正极材料LiCoO2的原料。以钴矿石(主要成分为Co3S4,含有少量FeO、Fe2O3、Al2O3等杂质)为原料制取Co3O4的工艺流程如图:
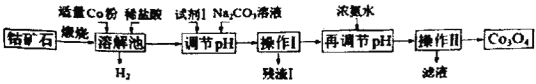
己知:Co与Fe为活泼金属,氧化性由强到弱的顺序为:Co3+>Fe3+>Co2+。
几种氢氧化物的溶度积如下表:
氢氧化物 | Co(OH)2 | Fe(OH)2 | Co(OH)3 | Al(OH)3 | Fe(OH)3 |
溶度积(Ksp) | 2.0×10-15 | 8.0×10-16 | 2.0×10-44 | 1.3×10-33 | 4.0×10-39 |
下列有关说法错误的是
A.溶解池中生成H2的离子反应方程式为:Co+2H+=Co2++H2↑
B.加入试剂1的目的是将Fe2+氧化为Fe3+,试剂1可选用双氧水或碘水
C.残渣1的主要成分为Fe(OH)3
D.操作Ⅱ包括过滤、洗涤、干燥和灼烧四个步骤