题目内容
【题目】化学学习和研究离不开元素周期表。下表为元素周期表的一部分,表中①-⑩分别代表一种元素。回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)上述元素中,有一种元素在自然界中形成的物质种类最多,该元素在周期表中的位置是_______。
(2)⑧、⑨、⑩元素的离子半径由大到小的顺序为________________(用离子符号表示)。
(3)写出由①、⑥、⑧三种元素形成的一种离子化合物的电子式__________________。
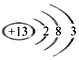
(4)上述元素中有一种元素的氧化物和氢氧化物都有两性,面出该元素的原子结构示意图______________;高温条件下,该元素的单质与铁红能发生反应,此反应常用于野外焊接钢轨,则该反应的能量变化可用图__________________表示。(填“甲“或“乙”)
(5)知W+X→Y+Z,且W、X、Y、Z分别是由①、⑤、⑥三种元素中的两种形成的10电子粒子,写出并配平上述反应式___________________________。
【答案】 第2周期第IVA族 Cl->Na+>Al3+ ![]()
 甲 NH4++OH-
甲 NH4++OH- ![]() NH3↑+H2O
NH3↑+H2O
【解析】①-⑩元素为:H、Li、Be、C、N、O、F、Na、Al、Cl。
(1)有一种元素在自然界中形成的物质种类最多,为C,其位置应为第二周期第IVA族;
(2)⑧、⑨、⑩元素的离子分别为:Na+、Al3+、Cl-,电子层越多的离子半径越大,相同电子层结构的离子,原子序数越大半径越小,所以其半径由大到小的顺序为Cl->Na+>Al3+;
(3)①、⑥、⑧三种元素形成的一种离子化合物为NaOH,其电子式为:![]()
(4)Al的氧化物和氢氧化物都有两性,其原子结构示意图为: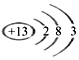 ,常用Al与Fe2O3野外焊接钢轨,反应为铝热反应,放出大量的热,反应的能量变化可用图甲表示。
,常用Al与Fe2O3野外焊接钢轨,反应为铝热反应,放出大量的热,反应的能量变化可用图甲表示。
(5)H、N、O三种元素中的两种形成的10电子粒子为:H2O、NH3、OH-、NH4+,符合W+X→Y+Z,所以上述反应式为:NH4++OH- ![]() NH3↑+H2O。
NH3↑+H2O。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】已知A,B,C,D,E,F,G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如表所示.
元素 | 原子结构特征或有关物质的性质 |
A | 原子的最外层电子数是其内层电子数的2倍 |
B | 其单质是空气中含量最多的物质 |
C | 原子的最外层电子数是其电子层数的4倍 |
D | 位于第ⅡA族,其原子半径比E的大 |
E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
F | 原子序数16,其单质在通常状况下为固体 |
G | 原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是 . 这七种元素中,不属于主族元素的元素的名称是 .
(2)在E,F,G三种元素中,原子半径最小的是(填元素符号).
(3)元素A与G可形成化合物AG4 , 在该化合物中含有的化学键类型为 , 分子的空间结构为 . A与氧元素可形成化合物AO2 , 该化合物分子的电子式为 .
(4)元素B能与氢元素形成化合物BH3 , 在通常状况下,BH3的水溶液呈(填“酸”、“碱”或“中”)性,原因为(用方程式表示)
【题目】在25℃时,密闭容器中X,Y,Z三种气体的起始浓度和平衡浓度如表,下列说法错误的是( )
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.改变温度可以改变该反应的平衡常数