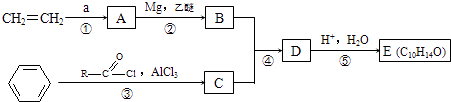
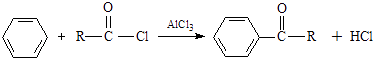题目内容
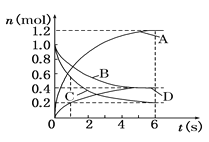
【题目】一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:

(1)表示NO2浓度变化的曲线是_____,写出相应的化学方程式:______________。
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=_________,a、b两点对应状态中,曲线x代表的物质的反应速率相对大小为:v(a)____v(b)。
(3)若平衡后改变温度,容器中气体平均摩尔质量变大,则反应向生成_____(填“NO2”或“N2O4”)的方向移动。
【答案】 x 2NO2![]() N2O4 0.4mol/(L·min) > N2O4
N2O4 0.4mol/(L·min) > N2O4
【解析】(1)根据图像,到达平衡,x的浓度降低了8 mol/L,y的浓度增大了4 mol/L,因此表示NO2浓度变化的曲线是x,反应的化学方程式为2NO2![]() N2O4,故答案为:x;2NO2
N2O4,故答案为:x;2NO2![]() N2O4;
N2O4;
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=![]() =
=![]() =0.4mol/(L·min);a、b两点对应状态中,根据2NO2
=0.4mol/(L·min);a、b两点对应状态中,根据2NO2![]() N2O4,v(NO2)=2 v(N2O4),则v(a)>v(b) ,故答案为:0.4mol/(L·min);>;
N2O4,v(NO2)=2 v(N2O4),则v(a)>v(b) ,故答案为:0.4mol/(L·min);>;
(3)若平衡后改变温度,容器中气体平均摩尔质量变大,说明气体的物质的量变小,则反应向生成N2O4的方向移动,故答案为:N2O4。

【题目】化学学习和研究离不开元素周期表。下表为元素周期表的一部分,表中①-⑩分别代表一种元素。回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)上述元素中,有一种元素在自然界中形成的物质种类最多,该元素在周期表中的位置是_______。
(2)⑧、⑨、⑩元素的离子半径由大到小的顺序为________________(用离子符号表示)。
(3)写出由①、⑥、⑧三种元素形成的一种离子化合物的电子式__________________。
(4)上述元素中有一种元素的氧化物和氢氧化物都有两性,面出该元素的原子结构示意图______________;高温条件下,该元素的单质与铁红能发生反应,此反应常用于野外焊接钢轨,则该反应的能量变化可用图__________________表示。(填“甲“或“乙”)
(5)知W+X→Y+Z,且W、X、Y、Z分别是由①、⑤、⑥三种元素中的两种形成的10电子粒子,写出并配平上述反应式___________________________。