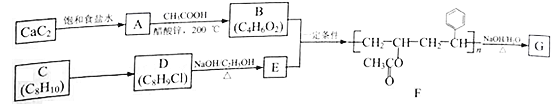
题目内容
【题目】下列分子的空间结构呈正四面体形的是
A.甲烷B.乙烯C.乙炔D.乙烷
【答案】A
【解析】
A.甲烷是正四面体形的分子,故A选;
B.乙烯是平面形的分子,故B不选;
C.乙炔是直线形的分子,故C不选;
D.乙烷中含有2个碳原子,每个碳原子与周围的4个原子形成四面体结构,乙烷是两个四面体以单键相连接的结构,不是正四面体结构,故D不选;
故选A。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g) + O2(g) ![]() 2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前5 min的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g)时,υ正> υ逆
C. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为40%
D. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ 的热量