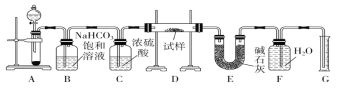
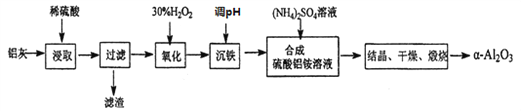
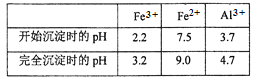
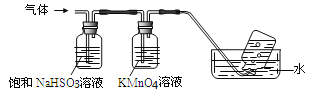
题目内容
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)反应A(g)+B(g)=C(g)+D(g),反应过程中能量变化如下图所示,回答下列问题:

①化学反应中产生能量变化的本质原因是______________;
②该反应是_____反应(填“吸热或放热”)、ΔH=__________ (用E1、E2表示);
③加入催化剂对该反应的ΔH是否有影响?___________。
(2)已知:一定条件下,拆开1molH-H键、1molCl-Cl键、1molH-Cl键需要的能量分别是436kJ、243kJ、432kJ,则反应H2(g)+Cl2(g)=2HCl(g) 的ΔH=_____。
(3)已知:2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ΔH1=-a kJmol﹣1
2CO(g)+O2(g)=2CO2(g) ΔH2=-b kJmol﹣1
H2O(g)=H2O(l) ΔH3=-c kJmol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为_________________________________。
【答案】 破坏反应物中化学键吸收的能量与形成生成物中化学键放出的能量存在差异 放热 E1-E2或-(E2-E1) 无影响 -185 kJmol﹣1 CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(1分) ΔH1=-(
O2(g)=CO2(g)+2H2O(1分) ΔH1=-(![]() 2c) kJmol﹣1
2c) kJmol﹣1
【解析】本题主要考查反应热的计算。
(1)①化学反应中产生能量变化的本质原因是破坏反应物中化学键吸收的能量与形成生成物中化学键放出的能量存在差异;
②该反应是放热反应、ΔH=E1-E2;
③加入催化剂对该反应的ΔH是否有影响?无影响。
(2)ΔH=(436+243-2×432) kJmol﹣1= -185 kJmol﹣1。
(3)将已知热化学方程式依次表示为A、B、C,2C-A/2-B/2得表示CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(1分) ΔH1=-(
O2(g)=CO2(g)+2H2O(1分) ΔH1=-(![]() 2c) kJmol﹣1。
2c) kJmol﹣1。