��Ŀ����
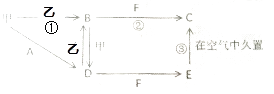
����Ŀ��������Ҫ����Ƥ�ë�ġ��ߵ�ֽ�š�Ⱦ�ϵ���ҵ���������ƴ�������ˮâ����Na2SO4����̿�ۻ�ԭ����������ʾ��ͼ��ͼ1�� 
��1�����������С������������A���뾭������д�������ƣ��������ɡ����ա�����������������Ϊ�����ʵ�����CO��CO2 �� д������ʱ�������ܵĻ�ѧ��Ӧ����ʽΪ ��
��2�����������в���ϡ��Һ������ˮ���ã������� ��
��3��ȡ���ƾ��壨������NaOH�����뵽����ͭ��Һ�У���ֽ��裮����Ӧ������Һ��pH=4�����ʱ��Һ��c�� S2����= �� ����֪������ʱCuS��Cu��OH��2��Ksp�ֱ�Ϊ8.8��10��36��2.2��10��20��
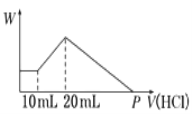
��4����Ƥ�﹤ҵ��ˮ�еĹ��������Ƴ�ȥ������ȥ��������Һ��pH��x��x�������Ƶ�ʵ�����������������ı�ֵ���йأ���ͼ2��ʾ����Ϊʹ����Ч����ѣ�Ӧ���Ƶ��������� �� ��ijë�ij���ˮ�к�0.001 molL��1�����ƣ���ֽ��Ư��ķ�ˮ����0.002 molL��1 NaClO����1��2������Ȼ�ϣ���ͬʱ�Ϻô������ַ�ˮ��������ķ�ˮ����������Ҫ�������� �� 
���𰸡�
��1�����ˡ����3Na2SO4+8C ![]() 3Na2S+4CO2��+4CO��
3Na2S+4CO2��+4CO��
��2����ˮ��ٽ�Na2Sˮ�⣬��ϡ��Һ������Na2Sˮ��
��3��4��10��36
��4��x=12��pH����9��10֮�䣻SO42����Cl��
���������⣺��1�����ڹ���A�Ǵ�Һ���л�ã����Եõ�A�IJ����ǹ��ˡ������������ʱ���������̿�ۣ��ҹ���A���Է��벢�������յ�Ӧ�ÿ�֪A��̿�ۣ���ѧʽΪC���������Ϣ��֪�������г��������������һ����̼�Ͷ�����̼������Ӧ���������ƺ�̼����������ʱһ����̼�Ͷ�����̼�ķ��Ӹ�������1��1�����Կ�����������Ļ�ѧ�������ֱ���1��1���ɵø÷�Ӧ�ķ���ʽΪ�� ![]() Na2SO4+2C
Na2SO4+2C ![]()
![]() Na2S+1CO2��+1CO�����÷�Ӧ����ͬ����4���õķ�Ӧ����ʽΪ��3Na2SO4+8C
Na2S+1CO2��+1CO�����÷�Ӧ����ͬ����4���õķ�Ӧ����ʽΪ��3Na2SO4+8C ![]() 3Na2S+4CO2��+4CO�������Դ��ǣ����ˡ����3Na2SO4+8C
3Na2S+4CO2��+4CO�������Դ��ǣ����ˡ����3Na2SO4+8C ![]() 3Na2S+4CO2��+4CO������2�����������в���ϡ��Һ������ˮ���ã�������Һ��������ˮ���Լ��ԣ�ˮ����������ȷ�Ӧ�����ȴٽ�ˮ����У�ϡ����Һ��������ˮ������ã����Դ��ǣ���ˮ��ٽ�Na2Sˮ�⣬��ϡ��Һ������Na2Sˮ�⣻��3��ȡ���ƾ��壨������NaOH�����뵽����ͭ��Һ�У���ֽ��裮����Ӧ������Һ��pH=4������ʱCuS��Cu��OH��2��Ksp�ֱ�Ϊ8.8��10��36��2.2��10��20 �� Ksp=c��Cu2+����c2��OH����=2.2��10��20 �� pH=4��c��OH����=10��10mol/L��c��Cu2+��=2.2mol/L����ͭ�е�Ksp=c��Cu2+��c��S2����=8.8��10��36������õ�c��S2����=4��10��36mol/L�����Դ��ǣ�4��10��36����4��������ͼ�������߷�������ȥ�������PH��x��ȡֵ��x=12��pH����9��10֮��ʱ����ȥ������ӽ�100%�����Դ��ǣ�x=12��pH����9��10֮�䣻��ijë�ij���ˮ�к�0.001molL��1�����ƣ���ֽ��Ư��ķ�ˮ����0.002molL��1 NaClO����1��2������Ȼ�ϣ���ͬʱ�Ϻô������ַ�ˮ���������ƺ����Ʒ���������ԭ��Ӧ��n��Na2S����n��NaClO��=0.001mol/L��1��0.002molL��1��2=1��4�����ݵ����غ������֪��Na2S+4NaClO=Na2SO4+4NaCl��������ķ�ˮ����������Ҫ��������SO42����Cl�� �� ���Դ��ǣ�SO42����Cl�� ��
3Na2S+4CO2��+4CO������2�����������в���ϡ��Һ������ˮ���ã�������Һ��������ˮ���Լ��ԣ�ˮ����������ȷ�Ӧ�����ȴٽ�ˮ����У�ϡ����Һ��������ˮ������ã����Դ��ǣ���ˮ��ٽ�Na2Sˮ�⣬��ϡ��Һ������Na2Sˮ�⣻��3��ȡ���ƾ��壨������NaOH�����뵽����ͭ��Һ�У���ֽ��裮����Ӧ������Һ��pH=4������ʱCuS��Cu��OH��2��Ksp�ֱ�Ϊ8.8��10��36��2.2��10��20 �� Ksp=c��Cu2+����c2��OH����=2.2��10��20 �� pH=4��c��OH����=10��10mol/L��c��Cu2+��=2.2mol/L����ͭ�е�Ksp=c��Cu2+��c��S2����=8.8��10��36������õ�c��S2����=4��10��36mol/L�����Դ��ǣ�4��10��36����4��������ͼ�������߷�������ȥ�������PH��x��ȡֵ��x=12��pH����9��10֮��ʱ����ȥ������ӽ�100%�����Դ��ǣ�x=12��pH����9��10֮�䣻��ijë�ij���ˮ�к�0.001molL��1�����ƣ���ֽ��Ư��ķ�ˮ����0.002molL��1 NaClO����1��2������Ȼ�ϣ���ͬʱ�Ϻô������ַ�ˮ���������ƺ����Ʒ���������ԭ��Ӧ��n��Na2S����n��NaClO��=0.001mol/L��1��0.002molL��1��2=1��4�����ݵ����غ������֪��Na2S+4NaClO=Na2SO4+4NaCl��������ķ�ˮ����������Ҫ��������SO42����Cl�� �� ���Դ��ǣ�SO42����Cl�� ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�