��Ŀ����
����Ŀ����֪A��EΪ�������ʣ�B�ǵ���ɫ��ĩ�ҳ����ڷ�������У��ش����⡣
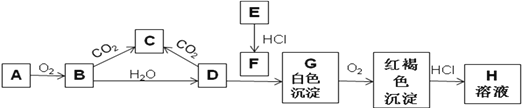
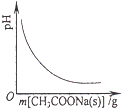
(1)ʵ������A����������ʢ��__________�Ĺ��ƿ�У�A��ɫ��ӦΪ__________ɫ��
(2)д��Bת���C�Ļ�ѧ����ʽ_______________________���÷�Ӧ����������_________����ԭ����___________��0.1molB����÷�Ӧ��ת�Ƶ��ӵĸ���Ϊ_________ ��
(3)д��D��F��Ӧ����G�����ӷ���ʽ��____________________________________________��
(4)����H��Һ�н��������ӵ�ʵ���Ҽ��鷽��______________________________________�����漰�������ӷ�Ӧ����ʽΪ��_________________________________��
���𰸡� ú�� �� 2Na2O2 + 2CO2 = 2Na2CO3 + O2 Na2O2 Na2O2 0.1NA Fe2++2OH-=Fe(OH)2�� ȡ����������Һ�������Թ��У��μӼ���KSCN��Һ������Һ�ʣ�Ѫ����ɫ����֤����Fe3+ Fe3+ + 3SCN- = Fe(SCN)3�����ߣ�ȡ����������Һ�������Թ��У��μӼ���NaOH��Һ�������ֺ��ɫ��������֤����Fe3+��Fe3+ + 3OH- = Fe(OH)3����
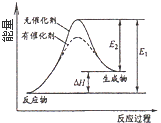
����������֪A��EΪ�������ʣ�B�ǵ���ɫ��ĩ�ҳ����ڷ�������У����B�ǹ������ƣ�A���ƣ�����������CO2��Ӧ����̼���ƺ���������C��̼���ƣ��������ƺ�ˮ��Ӧ�����������ƺ���������D���������ơ���ɫ����G��ת��Ϊ���ɫ��������G������������������E������F���Ȼ�������H���Ȼ�����
��1��ʵ�������Ƴ���������ʢ��ú�͵Ĺ��ƿ�У�����ɫ��ӦΪ��ɫ����2������������CO2��Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2CO2=2Na2CO3+O2��������������Ԫ�ػ��ϼ۴���1�۲������ߵ�0�ۡ����ֽ��͵���2�ۣ��������Ƽ�����������Ҳ�ǻ�ԭ����0.1mol�������Ʋ���÷�Ӧ��ת�Ƶ��ӵĸ���Ϊ0.1NA����3�������������Ȼ�������Ӧ�������������������ӷ���ʽΪFe2++2OH-=Fe(OH)2������4��һ����KSCN��Һ���������ӣ�������H��Һ�н��������ӵ�ʵ�鷽����ȡ����������Һ�������Թ��У��μӼ���KSCN��Һ������Һ�ʣ�Ѫ����ɫ����֤����Fe3+����Ӧ�����ӷ�Ӧ����ʽΪFe3++3SCN- =Fe(SCN)3��

 ���������������Բ��������ϵ�д�
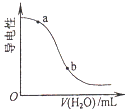
���������������Բ��������ϵ�д�����Ŀ��ijѧ����0.4000mol/L NaOH��Һ�ζ�δ֪Ũ�ȵ�������Һ��������ɷֽ�Ϊ���¼�����
��A���ñ���Һ��ϴ�ζ���2��3��
��B��ȡ��NaOH��Һע���ʽ�ζ�����0�̶�����2��3cm
��C����ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã�����Һ��ʹ�ζ��ܼ��������Һ
��D������Һ����0��0�̶����£����¶���
��E����ȡ10.00mL�����������Һע��ྻ����ƿ��������2��3�η�̪
��F������ƿ�µ�һ�Ű�ֽ���ñ�NaOH��Һ�ζ����յ㣬���µζ���Һ��Ŀ̶�
���������գ�
��1����ȥ��ʽ�ζ��������ݵķ���Ӧ������ͼ��������Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��
��2��E����������ƿ�µ�һ�Ű�ֽ��������
��3��ʵ���У������ֿ����������������ƣ����۾�Ӧע�� �� ֱ���ζ��յ㣮
��4�����εζ�����NaOH��Һ����������
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ�������mL�� | 20.05 | 20.00 | 18.80 | 19.95 |
���������Һ��ȷŨ��Ϊ �� ������С�����4λ��
��5���ñ���NaOH�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ������ɲⶨ���ƫ�ߵ�ԭ������ǣ� ����ѡȫ�ۣ�
A.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
B.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
C.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
D.δ�ñ�Һ��ϴ��ʽ�ζ���
E.��ʽ�ζ��ܵζ�ǰ�����ݣ��ζ�����첿�������ݣ�