题目内容
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如右图所示:
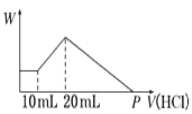
(1)混合物中NaOH的质量为_________________
(2)混合物中MgCl2的质量为_________________
(3)混合物中AlCl3的物质的量为_________________
(4)P点表示盐酸的体积是_________________
【答案】 1.8g 0.95g 0.005mol 90mL
【解析】试题分析:本题考查与Mg(OH)2、Al(OH)3有关的图像分析和混合物的计算。由图像知,开始加入10mL盐酸,沉淀既不增加也不减少,所以浑浊液中含NaOH;则NaOH、AlCl3、MgCl2的固体混合物溶于水时发生的反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=3NaCl+NaAlO2+2H2O;0.58g沉淀为Mg(OH)2。根据Mg守恒,n(MgCl2)=n[Mg(OH)2]= ![]() =0.01mol;根据图像知,加入10mL~20mL盐酸时发生的反应为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,n(NaAlO2)=n[Al(OH)3]=0.5mol/L
=0.01mol;根据图像知,加入10mL~20mL盐酸时发生的反应为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,n(NaAlO2)=n[Al(OH)3]=0.5mol/L![]() 0.01L=0.005mol,根据Al守恒,n(AlCl3)=n(NaAlO2)=0.005mol。
0.01L=0.005mol,根据Al守恒,n(AlCl3)=n(NaAlO2)=0.005mol。
(1)当加入20mL盐酸沉淀量达最大,发生的反应为NaOH+HCl=NaCl+H2O、NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,此时溶液中的溶质为NaCl,根据Na、Cl守恒,Na全部来自NaOH,Cl来自MgCl2、AlCl3和加入的20mL的盐酸,混合物中n(NaOH)=2n(MgCl2)+3n(AlCl3)+0.5mol/L![]() 0.02L=2
0.02L=2![]() 0.01mol+3
0.01mol+3![]() 0.005mol+0.01mol=0.045mol,m(NaOH)=0.045mol
0.005mol+0.01mol=0.045mol,m(NaOH)=0.045mol![]() 40g/mol=1.8g。
40g/mol=1.8g。
(2)混合物中m(MgCl2)=0.01mol![]() 95g/mol=0.95g。
95g/mol=0.95g。
(3)混合物中AlCl3物质的量为0.005mol。
(4)沉淀达最大时,沉淀由Mg(OH)2和Al(OH)3组成;溶解Mg(OH)2发生的反应为Mg(OH)2+2HCl=MgCl2+2H2O,溶解Mg(OH)2消耗HCl物质的量为2n[Mg(OH)2]=2![]() 0.01mol=0.02mol;溶解Al(OH)3发生的反应为Al(OH)3+3HCl=AlCl3+3H2O,溶解Al(OH)3消耗HCl物质的量为3n[Al(OH)3]=3
0.01mol=0.02mol;溶解Al(OH)3发生的反应为Al(OH)3+3HCl=AlCl3+3H2O,溶解Al(OH)3消耗HCl物质的量为3n[Al(OH)3]=3![]() 0.005mol=0.015mol;沉淀完全溶解消耗的HCl物质的量为0.02mol+0.015mol=0.035mol,消耗盐酸的体积为0.035mol
0.005mol=0.015mol;沉淀完全溶解消耗的HCl物质的量为0.02mol+0.015mol=0.035mol,消耗盐酸的体积为0.035mol![]() 0.5mol/L=0.07L=70mL,P点表示盐酸的体积为20mL+70mL=90mL。
0.5mol/L=0.07L=70mL,P点表示盐酸的体积为20mL+70mL=90mL。