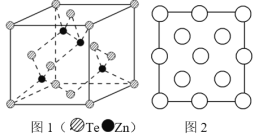
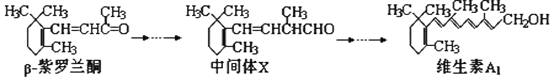题目内容
【题目】(1)下列物质中,既含离子键又含共价键的化合物是_________;同时存在σ键和π键的分子是_________,含有极性键的非极性分子是_________。
A.N2 B.C2H6 C.CaCl2 D.NH4Cl
(2)用“>”或“<”填空:
晶格能:Na2O_______KCl 酸性:H2SO4_______HClO4 离子半径:Al3+_______F-
【答案】D A B > < <
【解析】
(1)A.N2分子含有非极性共价键,属于单质,氮气分子结构简式为N≡N,所以氮气分子中含有σ键和π键的非极性分子;
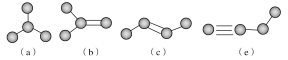
B.C2H6分子中碳原子和氢原子之间存在极性键,碳原子和碳原子之间存在非极性共价键,属于共价化合物,乙烷的结构式为![]() ,乙烷分子中只含σ键的非极性分子;
,乙烷分子中只含σ键的非极性分子;
C.CaCl2中只含离子键,属于离子化合物;
D.NH4Cl中铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在共价键,属于离子化合物,铵根离子中氮原子和氢原子之间存在σ键;
(2)离子化合物中,阴阳离子半径越小,离子所带电荷数越多,晶格能越大;非金属性越强,所对应元素的最高价含氧酸的酸性越强;具有相同电子排布的离子中,原子序数大的离子半径小。
(1)由分析可知:既含离子键又含共价键的化合物是NH4Cl;同时存在σ键和π键的分子是N2;含有极性键的非极性分子是C2H6。
(2)Na+的半径比K+半径小,O2-的半径比Cl-半径小,并且O2-带的电荷数比Cl-多,故晶格能:Na2O>KCl;
同周期从左向右非金属性增强,非金属性S<Cl,对应最高价含氧酸的酸性为H2SO4< HClO4;
具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径为Al3+< F-。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目