题目内容
【题目】(1)某单烯烃A碳原子数小于8,与HBr加成产物只有一种结构.且A与H2加成后,所得烷烃的一卤代物的同分异构体有3种,则A的结构简式为_________________.
(2)丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途.
①写出丙烯在一定条件下发生聚合反应的化学方程式______________.
②丙烯在乙酸作用下与O2反应生成有机物A,其蒸气密度是相同状况下甲烷密度的6.25倍,元素的质量分数为:碳60%、氧32%.A的分子式为__________.
(3)某烯烃与H2发生加成反应后得到的产物是CH3﹣CH(CH3)2.
①该产物的名称是____________________;
②写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式:_______________.
【答案】 CH3CH2CH=CHCH2CH3 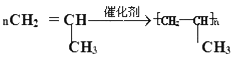 C5H8O2 2﹣甲基丙烷 CH2=C(CH3)2+Br2→CH2Br﹣CBr(CH3)2
C5H8O2 2﹣甲基丙烷 CH2=C(CH3)2+Br2→CH2Br﹣CBr(CH3)2
【解析】(1)对称烯烃与不对称分子加成后产物只有1种,所以碳原子数小于8的某单烯烃与HBr反应,其加成产物只有一结构,符合此条件的单烯烃有CH2=CH2、CH3CH=CHCH3、CH3CH2CH=CHCH2CH3、C(CH3)2=C(CH3)2,共4种,在这些单烯烃中,若与H2加成后,产物分别为CH3CH3、CH3CH2CH2CH3、CH3CH2CH2CH2CH2CH3、(CH3)2CHCH(CH3)2,氢原子的种类分别为1、2、3、2,烷烃的一卤代物的同分异构体分别为1种、2种、3种;2种,所以所得烷烃的一卤代物的同分异构体有3种,则A的结构简式为CH3CH2CH=CHCH2CH3;
(2)①丙烯中含有双键能发生聚合反应,反应方程式为: ;
;
②元素的质量分数为:碳60%、氧32%,则原子个数之比:C︰O︰H=![]() ︰
︰![]() ︰
︰![]() =5︰2
=5︰2![]() 8,有机物A蒸气密度是相同状况下甲烷密度的6.25倍,可以计算其相对分子质量为:16×6.25=100,分子式为:C5H8O2;
8,有机物A蒸气密度是相同状况下甲烷密度的6.25倍,可以计算其相对分子质量为:16×6.25=100,分子式为:C5H8O2;
(3)①CH3-CH(CH3)2正确命名为:2-甲基丙烷;
②根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置,因此相应烯烃分子中存在碳碳双键的位置只有1种,结构简式为:CH2=C(CH3)2;CH2=C(CH3)2使溴的四氯化碳溶液褪色是该烃中的不饱和键断裂,断键原子分别与溴原子相结合,生成新的化合物CH2Br-CBr(CH3)2,方程式为:CH2=C(CH3)2+Br2→CH2Br-CBr(CH3)。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验过程中的现象及结论均正确且存在因果关系的是
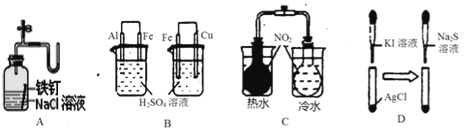
实验 | 实验现象 | 结论 |
A | 广口瓶中光亮的铁钉放置一段时间后生锈 | 铁钉发生析氢腐蚀 |
B | 左烧杯铁表面冒气泡,右烧杯铜表面冒气泡 | 金属活动性:Al>Fe>Cu |
C | 左烧杯气体颜色加深,右烧杯气体颜色变浅 | 2NO2(g) |
D | 白色固体先变为黄色,后变为黑色 | Ksp:AgCl<AgI<Ag2S |
A. A B. B C. C D. D