��Ŀ����
����Ŀ����2017�콭��ʦ���и���12���¿���ѧ�Ծ�������ijʵ��С��ͬѧ�Ե绯ѧԭ��������һϵ��̽�����
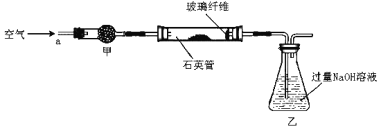
��1����ͼ1Ϊijʵ��С����Ƶ�ԭ���װ�ã���Ӧǰ���缫������ȣ�һ��ʱ������缫�������12 g��������ͨ��________mol���ӡ�

��2����ͼ�������������䣬�������ձ��е�CuCl2��Һ��ΪNH4Cl��Һ����ʯī�缫�ĵ缫��Ӧ����ʽΪ_____________________

��3����ͼ�������������䣬�������Ż�����ͭ������ʯī������n�ͣ�����ͼ��ʾ��װ������ͭ˿������ʯī�缫�Ϸ����ķ�Ӧ����ʽΪ_____________________
���������Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش��������⣺
��1�������͵�ȼ����ȣ�������Ϊȼ�ϵ��������Ե��ŵ���________________��д���㣩
��2�����������ĸ���ƷҲ����������Դ����ⷨ��ȡ�й㷺��;��Na2FeO4��ͬʱ����������ܷ�Ӧ����ʽΪ��Fe+2H2O+2OH![]() FeO42+3H2��������ԭ������ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��
FeO42+3H2��������ԭ������ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��

�����һ��ʱ���c(OH)���͵�������________________(������������������������)
���������У��뽫�������������弰ʱ�ų�����ԭ����______________________
��c( Na2FeO4)���ʼc(NaOH)�ı仯��ͼ2����ѡM��N�����е�һ�㣬����c(Na2FeO4)�������ֵ��ԭ��_____________��
���𰸡�������1��0.2mol ��2��2NH4++2e-��2NH3��+H2�� ��3��2Cl--2e-��Cl2��
������1��ȼ����ֵ�� ȼ������Ⱦ �ǿ�������Դ ��д���㣩��2����������
����ֹ���ɵ�H2��������Ʒ�Ӧ��ʹ�������ƵIJ��ʽ���
��M�㣺������Ũ��ƫС���������Ƶ��ȶ��Բ�ҷ�Ӧ������
N�㣺������Ũ�Ƚϴ����缫��������������������ʹ�������ƵIJ��ʽ���
��������
���������������1��ͼ1Ϊԭ��ط�Ӧ��FeΪ������������Fe-2e��=Fe2����ʯīΪ����������Cu2++2e-=Cu���ܷ�ӦʽΪFe+Cu2+=Fe2++Cu��һ��ʱ������缫�������12g����
Fe+Cu2+=Fe2++Cu ������������m ת�Ƶ���
56g 64g 56g+64g=120g 2mol
12g n
��n=0.2mol��
��2������CuCl2��Һ��ΪNH4Cl��Һ����Һ�����ԣ�笠��������ŵ磬�缫��ӦʽΪ2NH4++2e-��2NH3��+H2����
��3���������Ż�����ͭ������ʯī������n�ͣ���װ��Ϊ����������ʴ����Ϊ������ͭΪ�������������� O2+2H2O+4e-��4OH-���ʼ��ԣ��μӷ�̪����Һ��죬����װ��ͭΪ������ʯīΪ��������Ϊ����װ�ã���������2Cl--2e-��Cl2����
������1����������ȣ�������Ϊȼ�ϵ��ŵ�����ȾС������������Դ�㡢��Դ�ḻ��ȼ����ֵ�ߵȣ���2���������������缫�����ݲ����������ӷŵ��������������缫����������Ӧ����Һ�е����������Ӽ��٣���˵��һ��ʱ���c��OH-�����͵������������ң�
���������л�ԭ�ԣ���������Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ���������У��뽫�������������弰ʱ�ų�����ֹNa2FeO4��H2��Ӧʹ���ʽ��ͣ�
����������Na2FeO4ֻ��ǿ�����������ȶ�����M�㣬c��OH���ͣ�Na2FeO4�ȶ��Բ�ҷ�Ӧ������N�㣺c��OH-�����ߣ����缫���������������ɣ�ʹNa2FeO4���ʽ��͡�

 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�