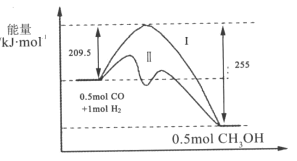
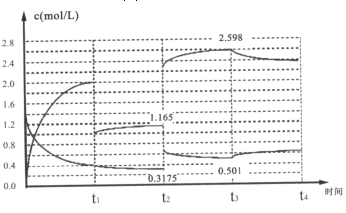
题目内容
【题目】按如图的装置进行电解实验:A极是铜锌合金,B为纯铜。电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加9.6g,溶液质量增加0.05g,则A极合金中Cu、Zn原子个数比为

A. 4:1 B. 1:1 C. 2:1 D. 任意比
【答案】C
【解析】
该装置是电解池,阳极上金属失电子发生氧化反应,阴极上铜离子得电子发生还原反应,所以阴极上增加的质量是铜的质量,溶液中增加的质量为溶解锌的质量与通过相同电子时析出铜的质量差,根据质量差可以计算溶解的锌的物质的量,再根据氧化还原反应中得失电子数相等计算合金上铜的物质的量,从而计算铜和锌的原子个数之比,据以上分析解答。
B极上析出的是铜,B极质量增加9.6g ,其物质的量=9.6/64=0.15mol,阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.05g ,即锌和铜的质量差为0.05g;设锌的物质的量为x,根据Zn+Cu2+=Zn2++Cu反应可知,1molZn完全反应,固体质量增加1g,现在固体质量增加0.05g,消耗锌的量x,即:1:1=x:0.05,x=0.05mol,即合金中锌的物质的量是0.05mol;根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设铜的物质的量为y,0.05×2+2y=0.15×2,y=0.1mol,所以铜和锌的物质的量之比为0.1:0.05=2:1,C正确;
综上所述,本题选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目