题目内容
用两根铂丝做电极插入KOH溶液中,再向两个电极上分别通甲烷气和氧气可形成原电池——燃料电池,根据两极反应的实质判断,
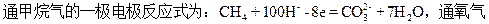
的一极,在下列叙述中正确的是
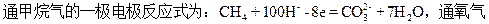
的一极,在下列叙述中正确的是
| A.阴极:4H2O+2O2+8e=8OH- |
| B.正极:4H2O+2O2+8e=8OH- |
| C.阴极:4OH--4e=2H2O+O2↑ |
| D.正极:4OH--4e=2H2O+O2↑ |
B
从CH4一极所发生的失电子电极反应式看,通CH4的一极应为原电池的负极,通氧的一极必为原电池的正极,正极应发生得电子的还原反应,且两极得失电子的数目相等,从题给选项看,应选B。

练习册系列答案
相关题目
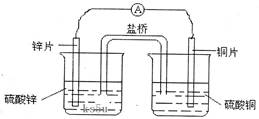
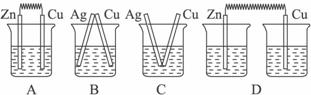
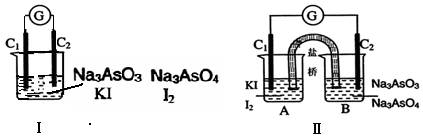
 AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。