题目内容
(08年江苏苏州等四市教学调查,12)下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应
“AsO43-+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是( )
“AsO43-+2I-+2H+
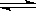 AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是( )
| A.甲组操作时,微安表(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变深 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为I2+2e-=2I- |
BD
本题考查原电池原理,较难题。图Ⅰ烧杯中逐滴加入适量浓盐酸,上
述平衡向正方向移动,溶液颜色加深,B对;但是氧化反应和还原反应在溶液中发生,不能形成原电池,A错;ⅡB烧杯中逐滴加入适量40%NaOH溶液,上述平衡向逆方向移动,氧化反应和还原反应在两极发生,形成原电池,其中C1上发生:I2+2e-=2I-,为原电池正极;C2上发生:AsO33――2e-+2OH-=AsO43―+H2O,为原电池负极,C错,D对。
述平衡向正方向移动,溶液颜色加深,B对;但是氧化反应和还原反应在溶液中发生,不能形成原电池,A错;ⅡB烧杯中逐滴加入适量40%NaOH溶液,上述平衡向逆方向移动,氧化反应和还原反应在两极发生,形成原电池,其中C1上发生:I2+2e-=2I-,为原电池正极;C2上发生:AsO33――2e-+2OH-=AsO43―+H2O,为原电池负极,C错,D对。

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目


 ,
,