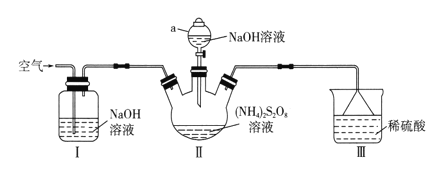
��Ŀ����
����Ŀ��Ϊ�˳�ȥ�����е�Ca2����Mg2����SO![]() ����ɳ���ɽ���������ˮ��Ȼ������������������
����ɳ���ɽ���������ˮ��Ȼ������������������
�ٹ��ˡ��ڼӹ���NaOH��Һ���ۼ�����HCl���ܼӹ���Na2CO3��Һ���ݼӹ���BaCl2��Һ
ͨ���̲��������ε��ᴿ�����������ĸ�ʵ��ش��������⣺
(1)�����岽�����У������е���________��
(2)ʵ���ҽ���NaCl��Һ������ʱ��һ�������²������̣�
�ٹ̶���Ȧλ�á� �ڷ��þƾ��ơ� �۷���������(��������ʢ��NaCl��Һ)�� �ܼ��Ƚ��衡��ֹͣ����
��ȷ�IJ���˳��Ϊ___________________��
(3)�ڴ��ξ���һϵ�в��������Һ�еμӹ�������Na2CO3��Һ�������ⲽ������Ŀ����___________________________________________���ж�Na2CO3��Һ�Ѿ������ķ�����_________________________________________________________________��
(4)ʵ�����ォ�����Ƴɾ��εĹ����У����ܽ⡢���ˡ�������������IJ����ж�Ҫ�õ����������ֱ�˵���������������ʹ�ò�������Ŀ�ģ�
�ܽ�ʱ��_________________________________________��
����ʱ��_________________________________________��
����ʱ��_________________________________________��
���𰸡� �� �ڢ٢ۢܢ� ��ȥCa2���Լ�����Ĺ���Ba2�� ȡ�ϲ���Һֱ�ӵ���Na2CO3��Һ�����ٲ������� ���裬�����ܽ� ����(��ʹ����Һ���ز���������©������ֹ����) ���裬��ֹ��ֲ�����Һ�λ���ɽ�
�������������к��е�Ca2����Mg2����SO42-����ɳ�����ʣ�����������ˮ���������BaCl2��Һ�Գ�ȥSO42-����ͬʱ������������Ba2+�����������Na2CO3��Һ�Գ�ȥBa2+��Ca2��������BaCl2��Һһ������Na2CO3��Һǰ�棬����NaOH��Һ��Ŀ�ij�ȥMg2�������ˣ����õ��ij���ȫ���˳������õ�����Һ�Ǻ�NaCl��Na2CO3��NaOH�ȵĻ�������HCl���Խ�һ����ȥCO32-��OH-���������ӣ��õ���Ϊ������NaCl��Һ���������һ��Ϊ����
��2������NaCl��Һʱ�����մ��µ��ϵ�˳���ȷ��þƾ��ƣ��ٹ̶���Ȧλ�ã�����������ʼ���Ƚ��裬��ʣ������Һ��ʱֹͣ���ȣ�������ȷ�IJ���˳��Ϊ�ڢ٢ۢܢ�
��3���ڳ��Ӳ����м������BaCl2��Һ�Գ�ȥSO42-����ͬʱ������������Ba2+�����������Na2CO3��Һ�Գ�ȥCa2��������Ba2+���ж�Na2CO3��Һ�Ѿ������ķ�������ȡ�ϲ���Һֱ�ӵ���Na2CO3��Һ�����ٲ������� ��
��4�����ܽ�ʱ�ò��������Ͻ����Լӿ��ܽ����ʣ�����ʱʹ���˻����Һ�����Ų���������©����������������������ֹ����©������������������Ҫ�ò��������Ͻ��裬��ֹ��ֲ�������ɵ�Һ��ɽ���

 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д�