题目内容
10.在同温同压下,合成氨反应N2+3H2═2NH3进行到某时刻达到平衡.起始时N2和H2共120体积,平衡时总体积为70体积,则原混合气体中N2和H2的体积比可能为( )| A. | 1:3 | B. | 9:15 | C. | 5:19 | D. | 1:1 |
分析 利用差量法计算参加反应的氮气、氢气的体积,利用极限法计算氮气、氢气的体积之比范围.
解答 解:N2+3H2═2NH3 体积减小△V
1 3 2
25体积 75体积 120体积-70体积=50体积
假设氮气完全反应,N2和H2的体积比为极小值,此时氢气为120体积-25体积=95体积,N2和H2的极小体积比25体积:95体积=5:19;
假设氢气完全反应,N2和H2的体积比为极大值,此时氮气为120体积-75体积=45体积,N2和H2的极大体积比45体积:75体积=3:5;
即N2和H2的体积比介于5:19~3:5之间,
故选A.
点评 本题考查化学方程式的有关计算,注意利用差量法与极限法进行解答,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列各组溶液中,c(NO3-)物质的量浓度最大的是( )
| A. | 500mL 1mol/L K NO3 | B. | 800mL 0.5mol/L Mg (NO3)2 | ||
| C. | 250mL 1mol/LFe(NO3)3 | D. | 200mL 1mol/L Ca(NO3)2 |
1.合理使用药物有利于身心健康.下列有关说法不正确的是( )
| A. | 氢氧化铝用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素 | |
| D. | 非处方药都无毒副作用、可长期大量服用 |
18.下列反应的离子方程式正确的是( )
| A. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ |
5.某同学在实验室中进行如下实验:
以下结论不正确的是( )
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  | 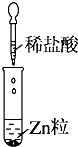 |
| 现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液不反应 | |
| B. | Ⅱ中的白色沉淀为BaSO4 | |
| C. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ | |
| D. | Ⅲ中发生的反应也是氧化还原反应 |
6.关于如图所示装置的叙述,不正确的是( )
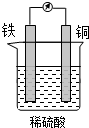

| A. | 铁片质量减小 | B. | 铜片质量不变 | ||
| C. | 铜片表面产生气泡 | D. | 溶液逐渐变蓝 |