题目内容
7.(1)铬酸根CrO42-呈黄色,重铬酸根Cr2O72-呈橙色.在水溶液中,铬酸根离子和重铬酸根离子存在下列平衡:Cr2O72-+H2O?2CrO42-+2H+.把重铬酸钾溶于水配成稀溶液呈橙色.向上述溶液中加入几滴浓硫酸,溶液橙色变深(填“变深”、“变浅”或“不变”),因为因为增大生成物浓度,平衡逆向移动,Cr2O72-浓度变大,颜色变深.(2)已知2NO2(g)?N2O4 (g)△H=-56.9kJ•mol-1,将NO2球浸泡在冰水中,气体的颜色将会变浅(填“变深”、“变浅”或“不变”),原因是降温平衡正向移动,NO2浓度变小,颜色变浅.
(3)在烧杯里混合10mL 0.01mol/L FeC13溶液和10ml 0.01mol/L KSCN溶液,溶液立即变红.已知反应:Fe3++3SCN-?Fe(SCN)3
①再向溶液中滴入1mol/LFeC13溶液,现象变深(变深、不变、变浅),平衡向正(正、逆)反应方向移动.
②在烧杯中加入KC1固体,颜色不变(变深、不变、变浅),平衡不移动.
分析 (1)加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大;
(2)正反应是放热反应,降低温度,平衡正向移动;
(3)①加入氯化铁,铁离子难度增大,平衡正向进行;硫氰酸钾难度减小;
②氯化钾对平衡无影响平衡不动.
解答 解:(1)加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色,故答案为:变深,因为增大生成物浓度,平衡逆向移动,Cr2O72-浓度变大,颜色变深;
(2)正反应是放热反应,降低温度,平衡正向移动,NO2浓度变小,气体的颜色变浅,故答案为:变浅,降温平衡正向移动,NO2浓度变小,颜色变浅;
(3)①FeCl3+3KSCN?Fe(SCN)3+3KCl反应,平衡为Fe3++3SCN-=Fe(SCN)3,滴入1mol/LFeC13溶液,铁离子浓度增大,平衡正向进行溶液颜色加深,平衡移动后KSCN浓度会减小,故答案为:变深,正;
②平衡为Fe3++3SCN-=Fe(SCN)3,加入KC1固体平衡不动,溶液颜色不变;故答案为:不变,不.
点评 本题考查化学平衡的影响因素,比较基础,注意建立平衡的微粒分析,题目较简单.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
10.在同温同压下,合成氨反应N2+3H2═2NH3进行到某时刻达到平衡.起始时N2和H2共120体积,平衡时总体积为70体积,则原混合气体中N2和H2的体积比可能为( )
| A. | 1:3 | B. | 9:15 | C. | 5:19 | D. | 1:1 |
15.下列物质易溶于水的是( )
| A. | 一氧化碳 | B. | 氮气 | C. | 硝酸钠 | D. | 氯化银 |
2.下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 300mL3.5 mol/L KCl溶液 | B. | 1000mL2.5mol/L NaCl溶液 | ||
| C. | 250mL1 mol/L AlCl3溶液 | D. | 200mL2mol/L MgCl2溶液 |
12.如果定义有机物的同系列是一系列结构式符合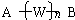 (其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
(其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
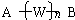 (其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
(其中n=0、1、2、3…)的化合物.式中A、B是任意一种基团(或氢原子),W为2价的有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )| A. | CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3 | |
| B. | CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3(CH=CH)3CHO | |
| C. | CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3 | |
| D. | ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3 |
19.c(H+)均为0.1mol•L-1的两种一元酸HX和HY溶液,分别取100mL加入足量的镁粉.充分反应后,收集到体积分别为VHX和VHY若相同条件下VHX>VHYX,则下列说法正确的是( )
| A. | HX可能是强酸 | B. | HY一定是强酸 | ||
| C. | HX的酸性强于HY的酸性 | D. | 反应开始时二者生成的速率相等 |
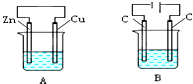 如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:
如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:
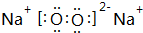 F的原子结构示意图为
F的原子结构示意图为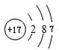 .
.