题目内容
18.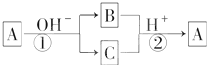 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列判断正确的是( )| A. | X元素可能为Al | B. | X元素可能为Si | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |
分析 由转化关系图可以看出,A这种单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,那么可以看出反应①应该是A物质的歧化反应,反应②应该是关于一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,则A可能为Cl2或S等非金属元素,据此答题.
解答 解:由转化关系图可以看出,A这种单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,那么可以看出反应①应该是A物质的歧化反应,反应②应该是关于一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,则A可能为Cl2或S等非金属元素,
A、根据上面的分析可知,元素X应该有变价,反应①和②都属于氧化还原反应,Al无变价,故A错误;
B、根据上面的分析可知,元素X应该有变价,反应①和②都属于氧化还原反应,Si无变价,故A错误;
C、反应①和②分别在碱性和酸性条件下进行,不是可逆反应,故C错误;
D、根据上面的分析可知,①应该是A物质的歧化反应,反应②应该是关于一种元素的归中反应,都是氧化还原反应,故D正确,
故选D.
点评 本题考查了元素化合物的性质推断,主要考查非金属元素的歧化反应和归中反应的特征应用,关键是理解金属无负价,题目难度中等.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
8.下列有关物质的性质描述不符合事实的是( )
| A. | 氧化铝是冶炼金属铝的原料,由于它熔点高,也是一种较好的耐火材料 | |
| B. | 在混有少量泥沙浑浊水两只试管分别加入少量明矾、硫酸铁溶液,水变得清澈 | |
| C. | 纯净的SiO2是现代光学及光纤制品的基本原料,也是人类将太阳能转化电能的常用材料 | |
| D. | 酸雨是由大气中SO2、NO2溶于雨水形成的 |
9.空气的成分中能供给呼吸的是( )
| A. | 氮气 | B. | 氧气 | C. | 稀有气体 | D. | 二氧化碳 |
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol甲烷含有的电子数为NA | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中含有的CO32-数目为0.1 NA | |
| C. | 1 L pH=1的硫酸溶液中含有的H+数为0.2 NA | |
| D. | 1 mol•L-1 FeCl3溶液中所含Cl-的数目为3NA |
10.强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)═H2O(1)△H═-57.3kJ/mol 已知:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O△H═-Q1kJ/mol
H2SO4(浓)+NaOH(aq)═Na2SO4(aq)+H2O(1)△H═-Q2kJ/mol
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(1)△H═-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O△H═-Q1kJ/mol
H2SO4(浓)+NaOH(aq)═Na2SO4(aq)+H2O(1)△H═-Q2kJ/mol
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(1)△H═-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
7.在无色溶液中能大量共存的是( )
| A. | K+、Ag+、NO3-、Cl- | B. | NH4+、Ba2+、Cl-、CO32- | ||
| C. | Na+、Ca2+、HCO3-、NO3- | D. | K+ Fe3+ Cl- SO42 |
8.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径A>B>D>C | B. | 原子序数d>c>b>a | ||
| C. | 离子半径C3->D->B+>A2+ | D. | a=c-5 |
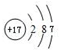 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7.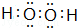 .
. .
.