题目内容
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是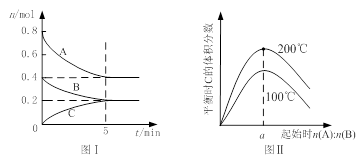
A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
AD
解析试题分析:A.200℃时,反应从开始到平衡的平均速率v(B)= (0.4-0.2)mol÷2L÷5min=0. 02 mol/(L·min)。正确。B:由图Ⅱ可知:当n(A):n(B)相同时,200℃时C的含量高于100℃时,说明升高温度,C的含量增大。化学平衡正向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。正反应方向为吸热反应。所以△H>0.错误。C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,由于没有改变任何物质的浓度,所以化学平衡不发生移动。v(正)=v(逆)。错误。D.由图Ⅰ可知该反应的方程式为2A+B C在加入AB之前,达到平衡时A的含量为:0.4÷(0.4+0.2+0.2)=0.5.若在200℃时,向容器中充入2 mol A 和1 mol B,由于增大了反应物的浓度,化学平衡正向移动,有更多的反应物变为生成物,所以达到平衡时,A 的体积分数必然小于0.5。正确。
C在加入AB之前,达到平衡时A的含量为:0.4÷(0.4+0.2+0.2)=0.5.若在200℃时,向容器中充入2 mol A 和1 mol B,由于增大了反应物的浓度,化学平衡正向移动,有更多的反应物变为生成物,所以达到平衡时,A 的体积分数必然小于0.5。正确。
考点:考查温度、浓度、压强对化学平衡、化学反应速率及物质含量的影响的知识。

 阅读快车系列答案
阅读快车系列答案在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)  2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 ( )
2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 ( )
| A.40% | B.50% | C.60% | D.70% |
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是:
| A.1.5mol/(L·min) | B.0.15mol/(L·min) |
| C.0.75mol/(L·min) | D.0.075mol/(L·min) |
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
2Z(g)一定达到化学平衡状态的是①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)  I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )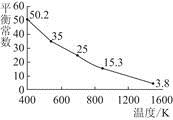
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
下列说法正确的是
| A.反应2Mg+CO22MgO+C ΔH<0从熵变角度看,可以自发进行 |
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
 2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是 2C(g)(正反应放热)。这个可逆反应的正确图像为( )
2C(g)(正反应放热)。这个可逆反应的正确图像为( )