题目内容
下列说法正确的是
| A.反应2Mg+CO22MgO+C ΔH<0从熵变角度看,可以自发进行 |
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
D
解析

练习册系列答案
相关题目
下列说法正确的是( )
| A.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0 ΔS>0 |
| B.凡是放热反应都是自发的,凡是吸热反应都是非自发的 |
C.常温下,2H2O 2H2↑+O2↑,即常温下水的分解反应是自发反应 2H2↑+O2↑,即常温下水的分解反应是自发反应 |
| D.对于反应H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
NO2和N2O4可相互转化:2NO2(g)  N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是
N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是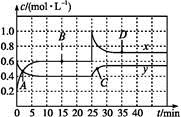
| A.图中共有两条曲线x和y,其中曲线y表示NO2浓度随时间的变化 |
| B.A、B、C、D四个点中,表示化学反应处于平衡状态的点是B和C |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
| D.若要达到与D相同的状态,在25 min时还可采取的措施是适当缩小容器体积 |
T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图(2)所示。
则下列结论正确的是
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1 |
B.容器中发生的反应可表示为3X(g)+Y(g)  2Z(g) 2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图(3)所示,则改变的条件是增大压强 |
 3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )  zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是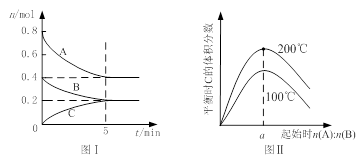
 ?C(g)+D(g)已达到平衡状态
?C(g)+D(g)已达到平衡状态  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )