题目内容
【题目】自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:KCl+NaNaCl+K+Q (Q<0) 有关数据如表:
熔点℃ | 沸点℃ | 密度 (g/cm3) | |
Na | 97.8 | 882.9 | 0.97 |
K | 63.7 | 774 | 0.86 |
NaCl | 801 | 1413 | 2.165 |
KCl | 770 | 1500 | 1.984 |
(1)请结合平衡移动理论分析,为什么能用该反应制备金属钾. .
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为℃,而反应的最高温度应低于℃.
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有 . (任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=
【答案】
(1)化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾)
(2)774;882.9
(3)适当的升高温度或移去钾蒸气
(4)生产工艺无污染,操作简便
(5)![]()
【解析】解:(1)工业上制取金属钾的化学原理是化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾),在常压下金属钾转为气态从反应混合物中分离,
所以答案是:化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾);(2)由表格数据可知,钾的沸点为774℃,所以金属钾转为气态最低温度约为774℃,反应时保证Na不能转化为气体,所以反应的最高温度应低于882.9℃,
所以答案是:774℃;882.9℃;(3)KCl+NaNaCl+K+Q (Q<0),该反应正反应为吸热反应,所以在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的升高温度或移去钾蒸气,
所以答案是:适当的升高温度或移去钾蒸气;(4)电解熔融氯化钾生成钾、氯气,氯气有毒,废气会污染环境,且电解需消耗大量电能,操作不及此法,
所以答案是:生产工艺无污染,操作简便;(5)当反应温度升高到900℃时,只有Na、K为气体,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则K= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
(1)Ⅰ.脱硝: 已知:H2的燃烧热为285.8kJmol﹣1
N2(g)+2O2(g)═2NO2(g)△H=+133kJmol﹣1
H2O(g)═H2O(l)△H=﹣44kJmol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为: .
(2)Ⅱ.脱碳: 向2L密闭容器中加入2molCO2和6molH2 , 在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)CH3OH(l)+H2O(l)
①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 . (填字母)
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H﹣H键断裂
③CO2的浓度随时间(0~t2)变化如图1所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2浓度随时间的变化.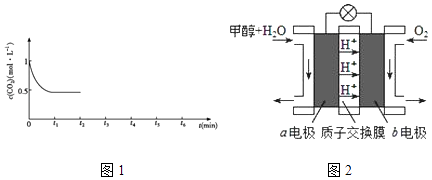
(3)改变温度,使反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0中的所有物质都为气态.起始温度、体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I)c(II).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)= . 在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1T2(填“>”、“<”或“=”).若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡移动(填“正向”“逆向”或“不”).
(4)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O═2HCOOH+O2 , 装置如图所示: ①电极2的电极反应式是;
②在标准状况下,当电极2室有11.2L CO2反应. 理论上电极1室液体质量(填“增加”或“减少”g.