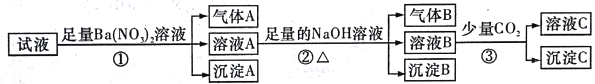
题目内容
【题目】根据问题填空:
(1)室温下: pH=13的CH3COONa溶液加水稀释100倍后,pH11(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl②(NH4)2SO4③NH4HSO4三种溶液中c(NH4+)由大到小的顺;
(3)等体积、等浓度的氢氧化钠与醋酸混合后,溶液中c(Na+)c(CH3COO﹣)(填“>”“=”或“<”); pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈性;
(4)用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图. 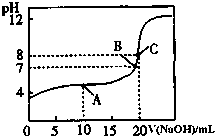
①为减小实验误差,由图可知滴定时指示剂应选用;(填“石蕊”、“酚酞”、“甲基橙”);
②A点的离子浓度大小关系是
③A,B,C三点所示溶液导电能力最强的是点对应的溶液;
④A,B,C三点水的电离程度大小关系是;
(5)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1molL﹣1盐酸③0.1molL﹣1氯化镁溶液④0.1molL﹣1硝酸银溶液中,C(Ag+)大小顺序: . (用序号表示)
【答案】
(1)>
(2)①=②>③
(3)>;酸
(4)酚酞;④>①>②>③;C(CH3COO﹣)>C(Na+)>C(H+)>C(OH﹣);C
(5)A<B<C
【解析】解:(1)pH=13的CH3COONa溶液加水稀释100倍,促进CH3COONa水解,溶液的pH变化小于2个单位,所以pH>11;
所以答案是:>;(2)相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4;则三种溶液中c(NH4+)由大到小的顺序为:①=②>③;
所以答案是:①=②>③;(3)等体积、等浓度的氢氧化钠与醋酸混合后生成CH3COONa,溶液显碱性,由于醋酸根离子水解浓度会减小,所以c(Na+)>c(CH3COO﹣);pH=1的醋酸,其浓度大于0.1mol/L,pH=13的氢氧化钠,其浓度等于0.1mol/L,等体积混合后,醋酸过量,为醋酸和醋酸钠的混合溶液,则溶液显酸性;
所以答案是:>;酸;(4)①氢氧化钠与醋酸恰好反应生成CH3COONa,溶液显碱性,所以选择在碱性条件下变色的指示剂,则选择酚酞;
所以答案是:酚酞;②A点时,溶液中溶质为CH3COONa和CH3COOH,溶液显酸性,CH3COOH的电离程度大于CH3COONa的水解程度,所以C(CH3COO﹣)>C(Na+)>C(H+)>C(OH﹣);
所以答案是:C(CH3COO﹣)>C(Na+)>C(H+)>C(OH﹣);③醋酸是弱电解质,在溶液中部分电离,随着氢氧化钠的加入,溶液中离子浓度增大,所以C点时氢氧化钠与醋酸恰好反应生成CH3COONa,溶液中离子浓度最大;
所以答案是:C;④酸电离的氢离子抑制水的电离,氢离子的浓度越大,水的电离程度越小,随着氢氧化钠的加入,溶液中氢离子浓度减小,所以水的电离程度增大,则水的电离程度A<B<C;
所以答案是:A<B<C;(5)①蒸馏水中含银离子浓度和氯离子浓度相同;②0.1molL﹣1盐酸溶液中氯离子浓度为0.1mol/L;抑制溶解沉淀平衡,Ag+浓度减小;③0.1molL﹣1MgCl2溶液中Cl﹣浓度为0.2mol/l,抑制程度溶解平衡,Ag+浓度减小,Cl﹣浓度越大,Ag+浓度越小;④0.1mol/L硝酸银溶液中Ag+浓度为0.1mol/L;抑制程度溶解平衡,Ag+浓度越增大,
则Ag+离子浓度大小为:④>①>②>③;
所以答案是:④>①>②>③.

【题目】自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:KCl+NaNaCl+K+Q (Q<0) 有关数据如表:
熔点℃ | 沸点℃ | 密度 (g/cm3) | |
Na | 97.8 | 882.9 | 0.97 |
K | 63.7 | 774 | 0.86 |
NaCl | 801 | 1413 | 2.165 |
KCl | 770 | 1500 | 1.984 |
(1)请结合平衡移动理论分析,为什么能用该反应制备金属钾. .
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为℃,而反应的最高温度应低于℃.
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有 . (任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=