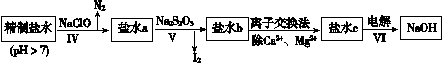
题目内容
已知:25 ℃时,CaCO3的Ksp=2.8×10-9,CaCO3在水中的溶解平衡曲线如图所示。下列说法正确的是
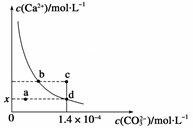

| A.x数值为1.4×10-5 |
| B.b点与d点对应的溶度积相等 |
| C.加入蒸馏水可使溶液由d点变到a点 |
| D.c点将有沉淀生成,平衡后溶液中c(Ca2+)、c(CO32-)一定相等 |
B
试题分析:CaCO3在水中的沉淀溶解平衡为CaCO3(s)
 Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4 mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5 mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5 mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
Ca2+(aq)+CO32-(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题。A、在d点c(CO32-)=1.4×10-4 mol?L-1,因室温时,CaCO3的溶度积Ksp=2.8×10-9,所以c(Ca2+)=2×10-5 mol?L-1,故x的数值为2×10-5,故A不正确;B、b点与d点在相同的温度下,溶度积相等,故B正确;C、d点为饱和溶液,加入蒸馏水后变为不饱和溶液,则c(Ca2+)、c(CO32-)都减小,故不可能使溶液由d点变成a点,故C错误;D、在c点c(Ca2+)>2×10-5 mol?L-1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,但平衡后溶液中c(Ca2+)、c(CO32-)不一定相等,故D不正确,答案选B。
练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
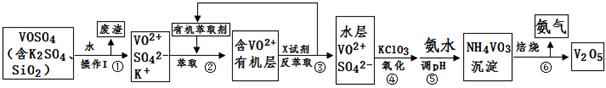
 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)