题目内容
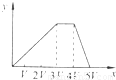
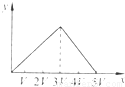
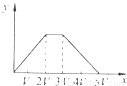
将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是( )A.
B.

C.
D.
【答案】分析:假定溶液中含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1mol.
关键弄清楚反应顺序,开始滴加时发生反应为Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol.
然后发生反应NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH.
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,物质的量之比等于体积之比.结合图象判断分析.
解答:解:假定溶液中含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1mol.
关键弄清楚反应顺序,开始滴加NaOH发生反应为Al3++3OH-=Al(OH)3↓,沉淀增大,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol,达最大值.
然后发生反应NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH.
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,三阶段消耗NaOH溶液的体积比为3:1:1.
A、由分析可知,开始滴加NaOH,立刻生成沉淀,沉淀达最大后,即铝离子完全反应,继续滴加NaOH,氢氧根与铵根离子反应,沉淀不变,当铵根离子反应完毕,加入的氢氧根与氢氧化铝反应,沉淀溶解,至最后消失,三阶段消耗NaOH溶液的体积比为3:1:1,图象A符合,故A正确;
B、离子反应的顺序错误,图为先与铵根离子反应,不符合反应过程,故B错误;
C、未画出铵根离子的反应、生成氢氧化铝沉淀与氢氧化铝溶解消耗的氢氧化钠得到物质的量不符合,故C错误;
D、三阶段消耗NaOH溶液的体积比为3:1:1,图中比例不符合,故D错误.
故选A.
点评:本题考查铝化合物的性质及计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应.
关键弄清楚反应顺序,开始滴加时发生反应为Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol.
然后发生反应NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH.
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,物质的量之比等于体积之比.结合图象判断分析.
解答:解:假定溶液中含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1mol.
关键弄清楚反应顺序,开始滴加NaOH发生反应为Al3++3OH-=Al(OH)3↓,沉淀增大,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol,达最大值.
然后发生反应NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变.
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH.
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,三阶段消耗NaOH溶液的体积比为3:1:1.
A、由分析可知,开始滴加NaOH,立刻生成沉淀,沉淀达最大后,即铝离子完全反应,继续滴加NaOH,氢氧根与铵根离子反应,沉淀不变,当铵根离子反应完毕,加入的氢氧根与氢氧化铝反应,沉淀溶解,至最后消失,三阶段消耗NaOH溶液的体积比为3:1:1,图象A符合,故A正确;
B、离子反应的顺序错误,图为先与铵根离子反应,不符合反应过程,故B错误;
C、未画出铵根离子的反应、生成氢氧化铝沉淀与氢氧化铝溶解消耗的氢氧化钠得到物质的量不符合,故C错误;
D、三阶段消耗NaOH溶液的体积比为3:1:1,图中比例不符合,故D错误.
故选A.
点评:本题考查铝化合物的性质及计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应.

练习册系列答案
相关题目