题目内容
某温度下,测得某溶液的pH=6,且氢离子与氢氧根离子物质的量相等,此溶液呈性.则此温度 室温(填高于、低于或等于),其理由是 . 将此温度下pH=10的NaOH溶液aL与pH=1的H2SO4溶液bL混合:(1)若所得混合液为中性,则a:b= .
(2)若所得混合液的pH=2,则a:b= .
【答案】分析:常温下中性溶液pH=7,c(H+)=c(OH-)=10-7mol/L,水的电离为吸热过程,升高温度促进水的电离,溶液c(H+)增大,pH=6,且氢离子与氢氧根离子物质的量相等,此时Kw=10-12,Kw=c(H+)×c(OH-),此温度下pH=10的NaOH溶液中c(OH-)=10-2mol/L,
pH=1的H2SO4溶液中c(H+)=10-1mol/L,以此可解答该题.
解答:解:常温下中性溶液pH=7,c(H+)=c(OH-)=10-7mol/L,水的电离为吸热过程,升高温度促进水的电离,溶液c(H+)增大,pH=6,c(H+)=c(OH-)=10-6mol/L,此时温度高于常温,
故答案为:高于;水的电离为吸热反应,升温有利于水的电离,使K增大;
(1)此温度下pH=10的NaOH溶液中c(OH-)=10-2mol/L,pH=1的H2SO4溶液中c(H+)=10-1mol/L,
若所得混合液为中性,则有10-2mol/L×aL=10-1mol/L×bL,
则a:b=10:1,
故答案为:10:1;
(2)若所得混合液的pH=2,则有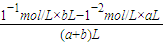 =10-2mol/L,
=10-2mol/L,
a:b=9:2,
故答案为:9:2.
点评:本题考查酸碱混合的计算,题目难度中等,注意水的电离特点,把握相关计算公式的运用.
pH=1的H2SO4溶液中c(H+)=10-1mol/L,以此可解答该题.
解答:解:常温下中性溶液pH=7,c(H+)=c(OH-)=10-7mol/L,水的电离为吸热过程,升高温度促进水的电离,溶液c(H+)增大,pH=6,c(H+)=c(OH-)=10-6mol/L,此时温度高于常温,
故答案为:高于;水的电离为吸热反应,升温有利于水的电离,使K增大;
(1)此温度下pH=10的NaOH溶液中c(OH-)=10-2mol/L,pH=1的H2SO4溶液中c(H+)=10-1mol/L,
若所得混合液为中性,则有10-2mol/L×aL=10-1mol/L×bL,
则a:b=10:1,
故答案为:10:1;
(2)若所得混合液的pH=2,则有
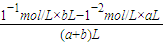 =10-2mol/L,
=10-2mol/L,a:b=9:2,
故答案为:9:2.
点评:本题考查酸碱混合的计算,题目难度中等,注意水的电离特点,把握相关计算公式的运用.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目