题目内容
材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下:
①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0 ℃ | 57.6 ℃ | -84.7 ℃ |
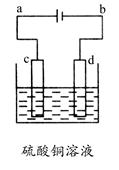
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。
①下列物质中不属于合金的是( )。
A.钢铁 B.青铜 C.硬铝 D.水银
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈。试写出保护铜制品的方法:___________________________________________________。
(3)纳米材料,胶体粒子的直径大约是________,与纳米材料的尺寸相当。实验室制取Fe(OH)3胶体溶液的方法是_________________________________,
用________方法消除胶体中的浑浊,根据________现象证明胶体已经制成。实验中必须要用蒸馏水,而不能用自来水,其原因是____________________。
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66 g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。①该磁性粉末中氧元素的质量分数为________;②该材料的化学式为________。
(1)①SiO2+2C Si+2CO↑ ②蒸馏
Si+2CO↑ ②蒸馏
(2)①D ②在干燥的环境下保存
(3)1~100 nm;在沸腾的蒸馏水中逐滴加入少量FeCl3饱和溶液,待溶液呈红褐色,停止加热,即制得胶体; 过滤; 丁达尔;自来水中含较多的阴离子和阳离子,能中和胶体粒子的电性,易使制备的胶体马上发生凝聚,导致实验失败
(4)①20.45% ②BaO·Fe2O3
解析试题分析:(1)提纯SiHCl2可利用沸点差异,用蒸馏的方法。
(2)硬铝是由Al、Cu、Mg、Mn、Si形成的合金,黄铜是Cu-Zn合金,钢铁是Fe与其他元素形成的合金。因此唯一不属于合金的是水银。
(3)胶体粒子直径的范围是:1~100 nm;利用FeCl3的水解反应制取Fe(OH)3胶体:在沸腾的蒸馏水中逐滴加入少量FeCl3饱和溶液,待溶液呈红褐色,停止加热,即制得胶体;难溶固体不能透过滤纸,胶体可透过滤纸,所以用过滤的方法,可消除胶体中的浑浊;胶体具有丁达尔现象,其它分散系不具备,所以用丁达尔现象可证明胶体已经制成;因为自来水中含较多的阴离子和阳离子,能中和胶体粒子的电性,易使制备的胶体马上发生凝聚,导致实验失败,所以不能用自来水制备胶体。
(4)①n(BaSO4)=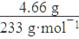 =0.02 mol,
=0.02 mol,
m(Ba)=137 g·mol-1×0.02 mol=2.74 g。
滤液中加入过量NaOH溶液,生成红褐色沉淀为Fe(OH)3沉淀。洗涤,灼烧后得3.20 g固体。此固体应是Fe2O3,则
n(Fe2O3)=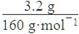 =0.02 mol,
=0.02 mol,
m(Fe)=56 g·mol-1×0.02 mol×2=2.24 g。
复合氧化物中氧元素的质量=6.26 g-2.74 g-2.24 g=1.28 g。
则氧元素的质量分数=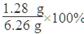 =20.45%。
=20.45%。
②1.28 g氧元素的物质的量是:
n(O)=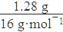 =0.08 mol。
=0.08 mol。
由以上计算知,复合氧化物中钡原子、铁原子、氧原子的物质的量之比是1∶2∶4,它们的原子个数比也是1∶2∶4。故该复合氧化物可表示为BaO·Fe2O3。
考点:本题考查物质的分类、保存与提纯、胶体的性质与制备、质量分数与化学式的计算。

下列说法不正确的是
| A.将Na2O2投入NH4CI溶液中只可能生成一种气体 |
| B.铁分别与稀盐酸和硫反应,产物中铁元素的化合价相同 |
| C.向饱和ZnS溶液中加入Na2S有沉淀析出,但KSP(ZnS)不变 |
| D.在滴有酚酞的Na2CO3溶液中,加入适量BaCl2溶液后溶液退色 |
有关元素X、Y、Z、D、E的信息如下:
| | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074 nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物可溶于水,且能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为___________。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_______。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)将Z单质在X的单质中燃烧的产物和等物质的量的Y单质同时通入足量的水中,充分反应后的溶液中滴入品红溶液,现象是__________________,有关反应的离子方程式为________________________________________________________________________。
已知下列元素的原子半径:
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10 m B.1.10×10-10 m C.1.20×10-10 m D.0.70×10-10 m