��Ŀ����
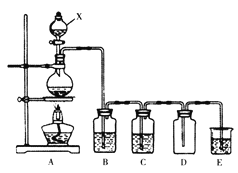
����Ŀ���������ʣ�������������Һ����ͭƬ����̼��ơ������ǡ������ڵ�NaCl����SO2���塢��̼�����ơ�������
��1���ܵ��������ڵ���ʵ���___________�������ţ�
��2��д��̼��Ƶĵ��뷽��ʽ____________________________________��
��3��д��̼���������������Ʒ�Ӧ�����ӷ���ʽ____________________________________��
��4����100mL1.5mol/L������������Һ�л���ͨ��һ������CO2����Ӧ����������Һ����λ����μ�һ��Ũ�ȵ����ᣬ���������������������������������������ܽ���ˮ����ϵ��ͼ��ʾ��
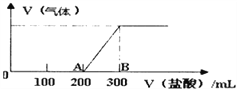
��
������������Һ��һ������CO2��ַ�Ӧ�����Һ������Ϊ_________��д��ѧʽ����
�������Ũ��Ϊ________________________��
��B��ʱ�������������ڱ�״���µ����Ϊ_________________L��
���𰸡� �� CaCO3==Ca2++ CO32- HCO3-+OH- ==CO32- + H2O NaOH��Na2CO3 0.5mol/L 1.12
����������1�����������ƶ����ӵ����ʿ��Ե��磬����ܵ��������ڵ���ʵ������ڵ�NaCl����ѡ����2��̼�����ȫ���룬̼��Ƶĵ��뷽��ʽΪCaCO3==Ca2++CO32-����3��̼���������������Ʒ�Ӧ�����ӷ���ʽΪHCO3-+OH-==CO32-+H2O����4����������200mLʱ��ʼ�������壬����������300mLʱ���ٲ������壬A��B�η���NaHCO3+HCl��NaCl+H2O+CO2������O��A�����ĵ�����ΪA��B���ĵ�����Ķ�����ӦΪNaOH��Na2CO3�Ļ����������300mL����ʱ���岻�ٷ����仯����ʱ��Һ�е�����Ϊ�Ȼ��ƣ������������غ��֪�Ȼ�����0.15mol�������Ȼ�����0.15mol��Ũ����0.15mol��0.3L��0.5mol/L��AB������HClΪ0.1L��0.5mol/L=0.05mol����NaHCO3+HCl��NaCl+H2O+CO2����֪���ɶ�����̼�����ʵ���Ϊ0.05mol������¶�����̼�����Ϊ��22.4L/mol��0.05mol=1.12L��